Оксид - тип
Cтраница 1
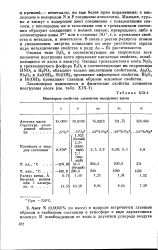 |
Некоторые свойства элементов подгруппы азота. [1] |
Оксиды типа Э205 и соответствующие им гидроксиды всех элементов подгруппы азота проявляют кислотные свойства, ослабляющиеся от азота к висмуту. Оксиды трехвалентного азота N203 и трехвалентного фосфора Р203 и соответствующие им гидроксиды HNO2 и Н3Р03 обладают только кислотными свойствами, As203, Sb2O3 и As ( OH) 3, Sb ( OH) 3 проявляют амфотерные свойства; Bi203 и Bi ( OH) 3 проявляют главным образом основные свойства. [2]
Оксиды типа Re2O7 имеют кислотный характер. [3]
Оксиды типа R2O7 имеют кислотный характер. [4]
 |
Кривые зави - nr R. [5] |
Оксиды типа R2O, RO и RO3 не подчиняются этим требованиям и самостоятельно не должны давать стекол, хотя в присутствии стеклообразователей могут входить в состав стекла. [6]
Оксиды типа МеО2 и высшей ступени окисления обладают уже кислотными свойствами. Есть основания полагать, что оксид никеля NiO2 имеет слабо выраженные кислые свойства. По-видимому, он способен вступать в соединения с сильно основными окислами, образуя так называемые нике-латы. [7]
Оксиды типа R2O7 имеют кислотный характер. [8]
Оксиды типа ЭО могут быть получены также восстановлением оксидов Э2Оз водородом или СО. [9]
Оксиды типа стибиотанталита АВО4 относятся к большой группе кислородно-октаэдри-ческих сегнетоэлектриков. [10]
Оксиды типа ЭО могут быть получены также восстановлением оксидов ЭгОз водородом или СО. [11]
 |
Защитное действие различных коллоидов. [12] |
Частицы оксидов типа М2Оз, защищенные гуминовыми кислотами, также вымываются в этих условиях. Остающиеся коагели характеризуются высоким содержанием SiO2 и малым содержанием питательных веществ, необходимых для растений. [13]
Частицы оксидов типа RaOs, высокодисперсные и покрытые в этих условиях защитными коллоидами - гуминовыми кислотами, также вымываются. Остающиеся коагели характеризуются высоким содержанием SiO2 и малым количеством питательных веществ, необходимых для растений. [14]
В оксидах типа Na2O ( К2О, Rb2O, Li2O) атомы кислорода ( за счет 2s, 2px -, 2ру - и 2р2 - орбиталей) с восемью соседними атомами металла объединяются посредством четырех трехцентровых связей. [15]
Страницы: 1 2 3 4