Оксид - тип
Cтраница 4
Корреляция между химическим составом сплавов, содержа нием оксидных фаз и противоокислительной стойкостью i обобщенном виде представлена на рис. 11.16. Можно видеть что образование оксидов типа ( а), - А12О3, NiAl2O4 i MR2O6 - отвечает лучшей стойкости, чем образование окси дов типа ( б), - Cr2Oj, NiCr2O4 и NiTiOj. [46]
Наружный слой оксидов ( 3 - 5 атомных слоев) состоит из Сг ( ОН) 3, а внутренний, по-видимому, из оксида шпи-нельного типа. Толщина оксидной пленки уменьшается с ростом продолжительности пассивации и содержания хрома в сплаве. Наименьшая толщина пленки ( 2 нм) достигается для высокохромистой стали после длительной выдержки. На основании полученных данных авторы работы [142] приходят к выводу, что первоначально состав пленки соответствует составу сплава, после выдержки в воде состав оксидного слоя изменяется за счет преимущественного перехода железа в раствор и сохранения хрома в пленке. [47]
Сдвиг потенциала до 2 7 - 2 8 В приводит к дальнейшему окислению платины с образованием оксида перекисного строения РЮ3; при 6 0 - 7 0 В появляются оксиды озонидного типа, еще более богатые кислородом. Показано [45], что с участием лабильного кислорода поверхностных оксидов платины при потенциалах выше 2 1 - 2 3 В начинается электрохимический синтез окислителей - хлорной и пероксодвусерной кислот, их солей, алифатических пероксоперхлоратов. [48]
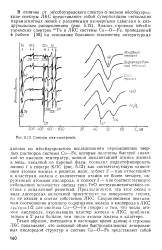 |
Спектры оже-электронов. [49] |
Си-Fe, которые получены быстрой закалкой от высоких температур, ионной имплантацией атомов железа в медь, закалкой из паровой фазы, позволил индентифицировать линию 1 в спектре КЛС ( рис. 5.12) как соответствующую одиночным атомам железа в решетхе меди, дублет 2 - как относящийся к кластерам железа с количеством атомов не более четырех, окруженных атомами кислорода, и полюсу 3 - как соответствующую небольшому количеству оксида типа FeO нестехиометрического состава с искаженной решеткой. Предполагается, что этот оксид в виде дисперсных включений присутствует на поверхности трения, но не входит в состав собственно ЛКС. Сохраняющееся неизменным соотношение атомного содержания железа и кислорода в ЛКС cFe / col / 2 для системы Си-О - Fe говорит о том, что число атомов кислорода, окружающих кластер железа в ЛКС, приблизительно в 2 раза больше, чем число атомов железа в кластере. [50]
Например, в оксидах со структурным типом NaCl каждый атом кислорода соединен тремя трехцентровыми связями с шестью соседними атомами металла ( к. А в оксидах типа Na2O координационное число достигает 8 и он образует четыре трехцентровые связи с 8 атомами металла. [51]
В присутствии кислорода вследствие диффузии вакансий в оксидных пленках продолжается окисление металла. Диффузия кислорода по вакансиям в оксидах типа MOi x и междоузлиям в оксидах Мц - хО направлена к поверхности металла и вызывает на ней образование новых слоев оксида. [52]
Все элементы VA-группы имеют оксиды типа Э2О5 и гидроксиды НЭО3 или НзЭО4, которые обладают кислотными свойствами. Кроме того, для них характерны оксиды типа Э2О3 и соответствующие гидроксиды НЭО2 или Н3ЭО3; у азота и фосфора они имеют кислотные свойства, у мышьяка и сурьмы амфотерны, а у висмута проявляют основной характер. [53]
Все элементы VA-подгруппы имеют оксиды типа Э2О5 и гидроксиды НЭО3 или Н3ЭО4, которые обладают кислотными свойствами. Кроме того, для них характерны оксиды типов Э2О3 и соответствующие гидроксиды НЭО2 или Н3ЭО3; у азота и фосфора они имеют кислотные свойства, у мышьяка и сурьмы амфотерны, а у висмута проявляют основной характер. [54]
Из лабораторных экспериментов исследования растворимости песчано-алевролитовых пород Предкарпатья в ГКР, которые уже обработаны СКР, известно, что во время обработки ГКР в пластовых условиях из породы удаляется около 60 % алюмосиликатов и 30 % карбонатов. Растворение SiCb начинается тогда, когда оксиды типа RO и R2O3 уже извлечены. [55]
На воздухе они быстро покрываются пленкой оксидов типа КзОз, которая предохраняет их от дальнейшего окисления. При температурах выше 180 - 200 С происходит интенсивное окисление РЗЭ. При прокаливании оксидов типа R2O3 образуются тугоплавкие белые порошки. Окраска оксидов Ей, ТЬ, Ег - розовая; Sm, Dy, Но - желтая; Рг и Тт - зеленая; Nd-голубая. Оксиды РЗЭ при взаимодействии с водой и соли РЗЭ при взаимодействии с водными растворами щелочей и аммиака образуют гидрокси-ды типа R ( OH) 3, которые не растворяются в воде, но растворяются в кислотах. При нагревании РЗЭ реагируют с Н2, С, N2, P, СО, С02, углеводородами, водой, кислотами. Хлориды, нитраты РЗЭ растворимы в воде; карбонаты и фосфаты трудно растворимы, а фториды не растворяются даже в концентрированных кислотах. При сплавлении с металлами РЗЭ легко образуют интерметаллические соединения. [56]
Это верно лишь для лития. Что же касается остальных щелочных металлов, то, хотя оксиды типа Ме2О для них и существуют, при горении щелочные металлы присоединяют большее количество кислорода. Для получения же оксидов типа Ме2О приходится использовать косвенные методы. [57]
Страницы: 1 2 3 4