Оксид - элемент
Cтраница 1
Оксиды элементов, находящихся в левой части таблицы, являются сильными основаниями. Для них характерно наличие большого отрицательного заряда на атомах кислорода, и по типу связи они принадлежат к ионным соединениям. Температуры плавления этих ионных оксидов, как правило, достигают 2000 С, но многие из них разлагаются уже при более низких температурах. [1]
Оксиды элементов в высшей степени окисления ( - ( - VI) СгОз, МоО3 и WO3 довольно летучи из-за высокой ковалентности связей элемент-кислород и устойчивы. В качестве гидроксидов им соответствуют кислота Н2СгО4, которая существует в виде молекул в водном растворе при рН1, и моно - и дкгидраты ЭО3 - Н20 и ЭО3 2Н2О ( Э - Mo, W), обладающие слабыми кислотными свойствами. Малорастворимые дигидраты получают при действии кислот на водные растворы щелочных молибда-тов и вольфраматов. [2]
Оксиды элементов этой подгруппы представляют собой тугоплавкие белые вещества. Гидроксиды проявляют основные свойства, усиливающиеся в ряду Sc-Y-La. Так, соли скандия гидролизуются в значительной степени, а соли лантана практически не подвергаются гидролизу: La ( ОН) з - сильное основание. [3]
Оксиды элементов, химически взаимодействуя с водой, способствуют смещению этого равновесия, в результате чего раствор становится либо кислым, либо щелочным. По этой причине гидроксиды являются характеристическими соединениями, поскольку свойства гидроксида определяют, в конечном итоге, принадлежность элемента к металлам или неметаллам. Следует, однако, подчеркнуть, что характеристическими в этом смысле свойствами гидроксиды обладают только в водных растворах. В других растворителях их кислотно-основные функции могут резко измениться. Например, оксид азота N2Or, с водой образует гидроксид HNO3, который в водном растворе является сильной кислотой. Это характеризует азот как типичный неметалл, a N2O5 как кислотный оксид. [4]
Оксиды элементов этой подгруппы представляют собой тугоплавкие белые вещества. Гидроксиды проявляют основные свойства, усиливающиеся в ряду Sc-Y-La. Так, соли скандия гидролизуются в значительной степени, а соли лантана практически не подвергаются гидролизу: La ( OH) s - сильное основание. [5]
Оксиды элементов этой подгруппы представляют собой тугоплавкие белые вещества. Гидроксиды проявляют основные свойства, усиливающиеся в ряду Sc-Y-La. Так, соли скандия гидролизуются в значительной степени, а соли лантана практически не подвергаются гидролизу: La ( OH) 3 - сильное основание. [6]
Оксиды элементов этой подгруппы представляют собой тугоплавкие белые вещества. Гидроксиды проявляют основные свойства, усиливающиеся в ряду Sc-Y-La. Так, соли скандия гидролизуются в значительной степени, а соли лантана практически не подвергаются гидролизу: Ьа ( ОН) з-сильное основание. [7]
Оксиды элементов этой подгруппы представляют собой тугоплавкие белые вещества. Гидроксиды проявляют основные свойства, усиливающиеся в ряду Sc-Y-La. Так, соли скандия гидролизуются в значительной степени, а соли лантана практически не подвергаются гидролизу: La ( OH) 3 - сильное основание. [8]
 |
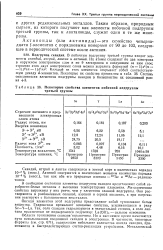
Некоторые свойства элементов побочной подгруппы третьей группы. [9] |
Оксиды элементов этой подгруппы представляют собой тугоплавкие белые вещества. Гидроксиды проявляют основные свойства, усиливающиеся в ряду Sc - Y - La. Так, соли скандия гидролизуются в значительной степени, а соли лантана практически не подвергаются гидролизу: La ( OH) s - сильное основание. [10]
 |
Некоторые свойства элементов побочной подгруппы третьей группы. [11] |
Оксиды элементов этой подгруппы представляют собой тугоплавкие белые вешества. Гидроксиды проявляют основные свойства, усиливающиеся в ряду Sc-Y-La. Так, соли скандия гидролизуются в значительной степени, а соли ла ь тана практически не подвергаются гидролизу: La ( OH) 3 - сильное основание. [12]
 |
Некоторые свойства элементов побочной подгруппы третьей группы. [13] |
Оксиды элементов этой подгруппы представляют собой тугоплавкие белые вещества. Гидроксиды проявляют основные свойства, усиливающиеся в ряду Sc-Y-La. Так, соли скандия гидролизуются в значительной степени, а соли лантана практически не подвергаются гидролизу: La ( OH) 3-сильное основание. [14]
Оксиды элементов в парах могут содержать мономеры, димеры, тримеры и другие полимеры. Полимерные оксиды образуют циклы. Так, в ( WOsb шестичленный цикл ( WO) 3 имеет конфигурацию кресло, в молекуле ( Мо03) 3 шестичленный цикл ( МоО) 3 практически плоский. [15]
Страницы: 1 2 3 4