Оксид - дейтерий
Cтраница 1
Оксид дейтерия ( D216O) имеет ТП 3 813 С, ТК 101 43 С. Получают изотопным обменом с HDS, фракционной дистилляцией, электролизом, окислением дейтерия. [1]
Тяжелая вода ( оксид дейтерия) D2O представляет собой изотопную разновидность воды, молекулы которой вместо атомов Н содержат атомы дейтерия. [2]
Вода тяжелая [ оксид Дейтерия ] D2O; М - 20 03; бц. [3]
 |
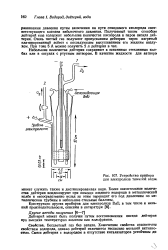
Схема установки для получения дейтерия путем взаимодействия тяжелой воды. натрием ( 1 - 4 текст. [4] |
Затем кран 4 закрывают и оксид дейтерия медленно перегоняют в сосуд / с металлическим натрием, охлаждая его жидким азотом. После перегонки для полного завершения реакции сосуд / нагревают в те-гение нескольких часов при 350 С. Потом открывают кран 4 и образовавшийся дейтерий перекачивают для очистки в приемник с древесным углем, яе содержащим газов. Здесь дейтерий оставляют на некоторое время при температуре - 196 С. Дейтерий, полученный при реакции со свежей порцией. [5]
Льюис первым получил тяжелую воду ( оксид дейтерия ], которую теперь используют в качестве замедлителя в ядерных реакторах. [6]
Какая вода - оксид протия, оксид дейтерия ( тяжелая вода) или оксид трития ( сверхтяжелая вода) замерзает при более высокой температуре. [7]
 |
Устройство прибора для электролиза тяжелой воды. [8] |
Дейтерий может быть получен путем восстановления оксида дейтерия при высоких температурах железом или вольфрамом. [9]
Кислотно-основные реакции, протекающие в среде оксида дейтерия, имеют общие закономерности с указанными реакциями в водных системах, поэтому они включены в этот раздел, рассматривающий кислотно-основное равновесие в воде, хотя с точки зрения химического поведения их следовало бы рассматривать в разделе, посвященном неводным растворителям. При некоторых исследованиях, например, при изучении изотопного эффекта дейтерия, требуется измерять pD как показатель кислотности растворов в тяжелой воде. [10]
В данной подсубпозиции классифицируется тяжелая вода ( или оксид дейтерия), которая по виду напоминает обычную воду и обладает теми же самыми химическими характеристиками; с другой стороны, их физические свойства слегка отличаются. Тяжелая вода используется как источник дейтерия и применяется в ядерных реакторах для замедления нейтронов, которые расщепляют атомы урана. [11]
Голдблат и Джонс [64 ] сопоставили данные трех методов анализа оксида дейтерия, содержащего небольшое количество водорода: а) восстановление железом с последующим масс-спектро-метрическим анализом, б) измерение плотности и в) метод ЯМР. [12]
При рН 3 водородные атомы реагента быстро обмениваются с оксидами дейтерия или трития, образуя соответствующие меченые восстановители. Отметим, что таким простым способом невозможно приготовить тетрадейтероборат натрия из тетрагидробората в силу быстрого гидролиза. [13]
При действии воды образуется насыщенный кетон ( ЕН) [108, 402], оксид дейтерия приводит к а-дейтерокетону ( ED) [402]; реакционноспособные алкилгалогениды дают а-алкилкето-ны [108, 402] ( см. разд. Действие ацилгалогенидов приводит к О-аци-лированию с образованием сложных эфиров енолов [399] ( см разд. Изомерная чистота енолятов сохраняется, если катионом является литий, но утрачивается при использовании натрия или калия, а также при переносе литиевого енолята в растворитель, способствующий диссоциации, например в ДМСО [ 402J - В сложных кетонах енолят ( 141) может подвергаться другим превращениям. [14]
Получаемый таким способом дейтерий еще содержит небольшие количества кислорода и паров оксида дейтерия. Очень чистый газ получают пропусканием дейтерия через нагретый платинированный асбест с последующим высушиванием его жидким воздухом. [15]
Страницы: 1 2 3 4