Оксокарбонат
Cтраница 1
Оксокарбонаты получают взаимодействием С02 с растворами щелочей или по обменным реакциям. Растворимы в воде лишь карбонаты натрия и элементов подгруппы калия. [1]
Оксокарбонаты получают взаимодействием СО2 с растворами щелочей или по обменным реакциям. Растворимы в воде лишь карбонаты натрия и элементов подгруппы калия. [2]
Оксокарбонаты получаются взаимодействием СО2 с растворами щелочей или по обменным реакциям. [3]
Оксокарбонаты получают взаимодействием СО2 с растворами щелочей или по обменным реакциям. [4]
Оксокарбонаты получают взаимодействием СО2 с растворами щелочей или по обменным реакциям. Растворимы в воде лишь карбонаты натрия и элементов подгруппы калия. [5]
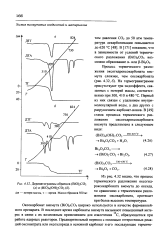 |
Дериватограммы образцов ( В. [6] |
Оксокарбонат висмута ( ВЮ СОз широко используется в качестве фармакопейного препарата. В последнее время карбонаты висмута вызывают повышенный интерес в связи с их возможным применением для извлечения С, образующегося при работе ядерных реакторов. [7]
 |
Микрофотографии образцов оксокарбоната висмута, полученного. [8] |
Оксокарбонат висмута может быть синтезирован непосредственным осаждением Bi при рН 8 добавлением висмутсодержащих азотнокислых или солянокислых растворов к растворам карбонатов натрия или аммония. Однако совместно с висмутом осаждаются и основные примесные металлы ( свинец, серебро, железо, цинк и др.), что не позволяет получать продукт высокой чистоты. Вследствие этого для получения оксокарбоната высокой чистоты в качестве исходного сырья требуется использовать предварительно очищенный металлический висмут или его оксид. [9]
Какие оксокарбонаты и еульфидокарбонаты нерастворимы в воде. [10]
 |
Зависимость молярного соотношения концентрации карбонат-ионов и висмута в осадке от значения я в системе при обработке оксокарбоната висмута растворами гидроксида. [11] |
Исследования по взаимодействию оксокарбоната висмута с растворами щелочных реагентов показали, что при обработке оксокарбоната водными растворами аммиака состав его не меняется. На кривой зависимости А - п при А 0 33 имеется пологий участок, отвечающий образованию оксогидроксокарбоната висмута. [12]
В отличие от оксокарбоната термограммы висмуторганических солей более сложны и отражают многостадийность этого процесса. В [51, 52] отмечено, что при проведении термического разложения в вакууме или атмосфере инертного газа конечным продуктом реакции являются металлический висмут или кислороддефи-цитные оксиды ( например, BiO), которые окисляются до Bi2O3 лишь при доступе воздуха. Таким образом, естественно предположить, что оксид, получаемый термическим разложением висмуторганических солей при температуре 270 - 400 С, в той или иной мере должен содержать в виде примеси металлический висмут. Это подтверждают наши исследования по синтезу оксида термическим разложением гидротартрата висмута [55], которые свидетельствуют, что окисление образующегося металла протекает в области температур 460 - 600 С. [13]
Морфология получаемого продукта существенно зависит от способа синтеза оксокарбоната и температуры процесса. [14]
Электронные микрофотографии оксида висмута, полученного термическим разложением оксогидроксонитрата, оксокарбоната и оксоацетата висмута, свидетельствуют, что оксид, получаемый в промышленности термическим разложением оксогидроксонитрата при 690 30 С, представляет собой агрегаты с размером - до 100 мкм ( рис. 4.8, а), образованные за счет объединения более мелких частиц при спекании. [15]
Страницы: 1 2 3