Биосинтез - аминокислота
Cтраница 2
В результате изучения биосинтеза аминокислот было выяснено, что аммиак чаще всего реагирует с кетокислотами. [16]
Специфические ферменты, регулирующие биосинтез аминокислот, широко распространены у бактерий; они с определенной глубиной изучены у Escherichia coli, Salmonella typhimurium, Bacillus subtilis и пр. У грибов, в ответ на аминокислотное лимитирование, отмечается некоординированное, параллельное возрастание уровня ферментов, катализирующих реакции биосинтеза различных аминокислот. Карсиотисом и сотрудниками, а позднее - у Saccharomyces cerevisiae, Aspergillus nidulans и других грибов. [17]
Мутагенные факторы могут изменить нормальный биосинтез аминокислот в клетке, воздействуя на генетический аппарат. Если в результате облучения или воздействия химических факторов ДНК не дает информацию для синтеза фермента и в клетке не синтезируется, например фермент гомосериндегидроге-наза, катализирующий превращение полуальдегида аспарагино-вой кислоты в гомосерин, то клетка может синтезировать необходимые для своего существования белки только в том случае, если в питательной среде уже содержится готовый гомосерин. Так как аспарагиновая кислота является исходным пунктом биосинтеза не только гомосерина, но и треонина, изолеицина, метио-нина, а также лизина, то отсутствие упомянутого фермента влияет на биосинтез всех этих аминокислот. Прекращение биосинтеза гомосерина одновременно прекращает биосинтез треонина, изолеицина и метионина, поэтому эти аминокислоты также должны содержаться в среде роста данной культуры. В данных условиях весь ход биосинтеза аминокислот в клетке идет в направлении от аспарагиновой кислоты к лизину. [18]
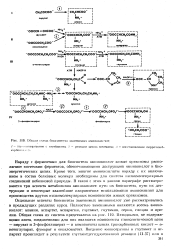 |
Общая схема биосинтеза заменимых аминокислот. [19] |
Наряду с ферментами для биосинтеза аминокислот живые организмы располагают системами ферментов, обеспечивающими деструкцию аминокислот в биоэнергетических целях. Кроме того, многие аминокислоты наряду с их включением в состав белковых молекул необходимы для синтеза низкомолекулярных соединений небелковой природы. В связи с этим в данном параграфе рассматриваются три аспекта метаболизма аминокислот: пути их биосинтеза, пути их деструкции и некоторые важнейшие направления использования аминокислот для производства других низкомолекулярных компонентов живых организмов. [20]
Еще один механизм регуляции биосинтеза аминокислот основан на контролируемом изменении концентрации ферментов, участвующих в биосинтезе. Если клетки не нуждаются в той или иной аминокислоте, будучи ею вполне обеспечены, то в них содержится очень мало ферментов, необходимых для ее биосинтеза. [22]
Помимо описанных практических сторон биосинтеза аминокислот микроорганизмами, они необходимы для решения ряда теоретических вопросов. Потребности народного хозяйства в аминокислотах огромны. [23]
Количество данных, касающихся биосинтеза аминокислот, очень велико, но о ранних стадиях биосинтеза известно меньше, чем о более поздних. Миллер [2] сделал очень интересную попытку подойти к решению проблемы первичного образования органических веществ на земле: он показал образование аминокислот ( глицин, саркозин, DL-аланин, ( 3-аланин, DL-a - аминомасляная кислота и а-аминоизомасляная кислота), а также других соединений ( молочная, муравьиная и уксусная кислоты) в системе, содержащей метан, аммиак, водород и воду. [24]
Из сравнения с бактериальными системами биосинтеза аминокислот [67] явствует, что у высших растений переаминирование, возможно, является последней ступенью в биосинтезе глицина, аланина, валина, лейцина, изолейци-на, аспартата, фенилаланина, тирозина, а также, возможно, серина. [25]
В данной теме мы подробно рассмотрим пути биосинтеза аминокислот и регуляцию этих процессов у микроорганизмов. В качестве общих закономерностей начальных этапов отметим следующее. [26]
Оксокислоты выступают в качестве интермедиатов зависимого от пиридоксаля биосинтеза аминокислот. Можно имитировать стереоспецифи-ческий 1 3-протонный перенос в таком амине, как ( 4), с помощью простого основного катализа [15], однако более близкие модели ферментативного процесса, по-видимому, недоступны. Наиболее эффективное превращение оксокислота - аминокислота включает много стадий схема ( 13), где асимметрический имин сначала восстанавливается, а затем вновь окисляется. [27]
Нек-рые мРНК прокариот ( чаще всего кодирующие ферменты биосинтеза аминокислот) кроме основных транслируемых последовательностей ближе к их 5 -концу содержат регуляторную последовательность, в к-рой закодирован короткий полипептид ( этот район мРНК носит назв. Синтез этого полипептида происходит во время образования мРНК и может приводить к преждевременному окончанию синтеза последней. [28]
Как видно из рис. 24, регуляция ферментов биосинтеза аминокислот семейства аспарагиновой кислоты идет как путем ингиби-рования конечными продуктами, так и при действии механизмов репрессии. [29]
Возможность того, что ферменты, участвующие в биосинтезе протеи-ногенных аминокислот, не обладают абсолютной специфичностью и могут катализировать образование структурно близких непротеиногенных аминокислот, будет рассмотрена далее ( стр. Гипотезы, согласно которым некоторые непротеиногенные аминокислоты могут играть защитную роль в образующих их растениях, повышая их выживаемость ( здесь, впрочем, как и в случае подобных теорий относительно роли алкалоидов в растениях, существует неясность относительно природы предполагаемых врагов растения), требуют, чтобы эти соединения взаимодействовали с важными промежуточными этапами обмена веществ животного, поедающего растение. Известны лишь немногие примеры такого взаимодействия. Один из таких примеров - действие ( 3 - ( мети-ленциклопропил) - аланина ( гипоглицин А из плодов Blighia sapida), который, по-видимому, оказывает ингибирующее действие на ( 3-окисле-ние жирной кислоты, возможно на уровне кротоназы, что приводит к необычному использованию углеводов в процессе дыхания, вследствие чего возникает гипогликемия. Непосредственное действие аналога было отмечено в одном или двух случаях, когда непротеиногенные аминокислоты оказываются способными стехио-метрически замещать нормальную аминокислоту в белковых молекулах. В качестве примеров можно привести замену аргинина канаванином в белках Staphylococcux aureus и замену нролина азетидин-2 - карбоновой кислотой в белках у растений и бактерий. [30]
Страницы: 1 2 3 4
