Бис-комплекс
Cтраница 2
Трис-1 10-фенантролиновый комплекс железа ( П) [ Fe ( Phen) 3 ] 2 является низкоспиновым комплексом, имеет большую константу устойчивости и окрашен в интенсивно-красный цвет. Соответствующий бис-комплекс меди ( I) [ Cu ( Phen) 2 ] менее устойчив. Введение метальных групп в положение 2 9 создает стерическое затруднение, препятствующее образованию трис-комплекса железа ( II); образующийся высокоспиновый бис-комплекс железа ( II) бесцветен. [16]
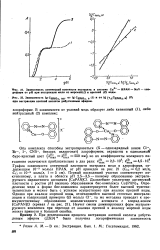 |
Зависимость lg CHNO3 орг от lg СНМОз в ( 1 и от lg ( у Сн Оз, ( 2 при экстракции азотной кислоты днбутиловым эфиром. [17] |
Первый восходящий участок соответствует постепенному, а плато в области рН 2 5 - 3 5 - полному образованию экстрагируемого окрашенного ассоциата [ CuPAN ] Cl. Определение меди в форме бис-комплекса характеризуется более высокой чувствительностью и может быть с успехом осуществлено при анализе пресной воды. Неучет смены доминирующих форм экстрагируемого комплекса при переходе от анализа пресной к анализу морской воды может привести к большой ошибке. [18]
Примерами соединений, где более важен последний эффект, могут служить прочные комплексы, образованные с содержащими серу анионными лигандами, например с диэтил-дитиокарбаматом, дитиооксалатом, р-меркаптопропионатом, р-изотиоуреидопропионатом и двухзарядными анионами рубеано-водородной кислоты и хиноксалин-2 3-дитиола. Стабилизация полем лигандов является решающим фактором при образовании бис-комплексов Ni ( II) с диоксимами, например с диметилглио-ксимом; эти комплексы используются в большинстве наиболее важных гравиметрических и спектрофотометрических методов определения никеля. Связи в этих комплексах образуются за счет четырех атомов азота, и их сильные поля обусловливают значительную энергию стабилизации получающегося плоского квадратного комплекса. Малая склонность к заполнению других мест вокруг атома металла объясняет экстрагируемость комплексов неполярными растворителями типа хлороформа, что обеспечивает возможность отделения Ni от ионов типа Со2, образующих окта-эдрические комплексы. [19]
В качестве осадителей было предложено использовать ли-ганды, аналогичные диоксимам по их способности образовывать пятичленные циклы с ионом никеля за счет его связей с атомами азота. В тех случаях, когда можно написать структуры, аналогичные бис-комплексу с диметилглиоксимом, получаются нерастворимые комплексы никеля. [20]
Пространственные затруднения при координации могут быть следствием довольно незначительных изменений структуры ли-ганда. Трис-1 10-фе-нантролиновый комплекс Ее ( II) ( но не моно - или бис-комплекс) является низкоспиновым и имеет большую константу устойчивости. [21]
В тех же условиях магний мешает незначительно, так как для него предпочтительна октаэдрическая конфигурация; расположенные вокруг иона металла лишние молекулы воды препятствуют экстракции. Ни один из комплексов алюминия не экстрагируется, поскольку как моно -, так и бис-комплексы его имеют заряд. [22]
Наиболее прочные комплексы торий дает с полианионными содержащими кислород лигандами, обычно когда образуются би-дентатные внутрикомплексные соединения. В качестве примеров таких реагентов, применяемых для фотометрического определения тория, можно назвать морин ( дающий в слабокислых растворах бис-комплекс), ализариновый красный S, кверцетин, хинализарин и пирокатехиновый фиолетовый. [23]
В литературе часто можно встретить утверждение, что два соединения обладают одинаковой абсолютной конфигурацией, хотя при этом они могут быть совершенно разными по составу. Не является, например, необычным то обстоятельство, что структуры XXXIII и XXXV для трис - и цис - бис-комплексов с бидентатными лигандами описываются как структуры с одинаковой абсолютной конфигурацией. [24]
В некоторых случаях небольшие изменения в лиганде могут вызвать увеличение специфичности. Это положение хорошо иллюстрируется реагентами группы 1 10-фенантролина. Бис-комплекс двухвалентного железа с 1 10-фенантролином имеет довольно низкую константу устойчивости, и его d - электроны находятся в высокоспиновом состоянии. Он очень легко присоединяет дополнительную молекулу 1 10-фенантролина с образованием; устойчивого трис-комплекса, в котором все d - электроны спарены. Однако в 2 9-диметил - 1 10-фенантролине LVII метальные группы оказывают стерические препятствия образованию трис-комплекса двухвалентного железа, так что эта характерная полоса поглощения отсутствует. С другой стороны, метальные группы не мешают образованию тетраэдрического бис-комплекса с ионом одновалентной меди, который, как и бис-комплекс незамещенного 1 10-фенантролина, обладает интенсивной желтой окраской и в котором, вероятно, осуществляется переход с заполненной орбитали tzg на я - орбиталь. Слабость связи металл-лиганд в комплексе бис ( 2 9-диметил - 1 10-фенантролин) железо ( II) и отсутствие окраски позволяют применить 2 9-диметил - 1, 10-фенантролин ( не-окупроин) в качестве чувствительного и селективного реагента на медь даже при высоких концентрациях двухвалентного железа. [25]
Образование PdCb бис-комплекса с р-фурфуральдоксимом служит примером, когда неорганическое соединение уже является нейтральной молекулой. Другим осадителем для PdClz является п-нитрозодифе-ниламин. В этом случае бис-комплекс образуется в результате связывания иона металла амино - или нитрозо-группой. [26]
Замена фенильной группы на метильную, приводящая к образованию метил-2 - пиридилкетоксима, не оказывает заметного влияния на комплексообразующую способность реагента, однако увеличивает растворимость в воде как самого реагента, так и его комплексов с металлами. Максимумы поглощения комплексов сдвигаются в более коротковолновую область, так что кислые растворы его трис-комплекса с железом ( II) имеют оранжево-красную окраску. Медь ( I) образует желтовато-зеленый бис-комплекс. [27]
Роданидный комплекс железа ( III) является комплексом с переносом заряда, чем объясняется его интенсивно красная окраска. Интенсивность окраски возрастает с увеличением числа лигандов, расположенных вокруг железа ( III), из-за возрастания вероятности перехода электронов от иона роданида к иону железа. Кажущийся молярный коэффициент поглощения е бис-комплекса приблизительно в два раза выше, чем моно-комплекса. [28]
Палладий образует также нерастворимые в воде комплексы с диэтиламинобензили-денроданином, 1-нитрозо - 2-нафтолом и 2-нитрозо - 1-нафтолом. Подобно никелю, палладий образует с диметилглиоксимом нерастворимый бис-комплекс, который можно экстрагировать хло-роформом. Другие диоксимы также дают эту реакцию, причем лучшим реагентом является а-фурилдиоксим. Окрашенный комплекс с палладием образует также салицилальдоксим. Основное различие между соответствующими комплексами Pd ( II) и Ni ( II) заключается в большей кинетической инертности первых. [29]
По электростатическим причинам введение содержащих кислород двух - и трехзарядных анионов типа тартратов или цитратов благоприятствует образованию комплексов с трехзарядными катионами; комплексообразование с двухзарядными катионами гораздо слабее, но тем не менее оно часто имеет в анализе важное значение. Неизбирательность таких реагентов, как р-дике-тоны и купферрон, лишь слегка изменяется в случае лигандов типа 8-оксихинолина и антраниловой кислоты, где в образовании связи принимают участие кислород аниона и атом азота. Наоборот, существование сильного поля лигандов и образование в бис-комплексе с диметилглиоксимом ковалентных связей с четырьмя атомами азота приводят к повышению прочности комплекса Ni ( II) ( система d8), но не комплекса Fe ( III) ( d5) или ионов непереходных металлов. [30]
Страницы: 1 2 3