Определение - фазовое равновесие
Cтраница 1
Определение фазовых равновесий при повышенных температурах в системах н-гексана и н-гексадекана с двуокисью углерода / / Нефтепромысловое дело и транспорт нефти. [1]
Для определения фазового равновесия, в особенности в системах жидкость - твердое ( Ж - Т), применяют диаграммы фазового состояния, в которых одно из свойств системы, например температуру кристаллизации или температуру кипения, определяют как функцию состава по опытным данным. Например, для определения температуры фазового перехода равномерно нагревают твердый материал или охлаждают расплав. При температуре, отвечающей кристаллизации расплава ( или плавлению твердого), прекращается или замедляется снижение ( или повышение) температуры за счет выделения или затраты теплоты кристаллизации. На кривой t / ( т) появляется горизонтальный участок в период кристаллизации или плавления. Анализ диаграмм фазового состояния позволяет определять равновесный выход и условия, дающие максимальное приближение реального производственного процесса к равновесному. [2]
Простейшим образом определение фазового равновесия может Гыть осуществлено в аппарате ( рис. 50), собранном из стандартных деталей по нормалям дестинорм. В испаритель 1 загружают 250 - 400 мл смеси и нагревают ее до кипения. По термометру наблюдают за изменением температуры. Одновременно отбирают пробу жидкости из испарителя. Измерения необходимо повторять несколько раз до получения при отборе пробы одинаковой концентрации три раза подряд. Для измерения при атмосферном давлении очень удобен прибор t для взятия пробы, работающий по принципу шприца. При определениях в вакууме применяют прибор для отбора проб ( см. рис. 103), пригодный также и при работе под атмосферным давлением, который позволяет избежать соприкосновения пробы со смазкой крана. Концентрацию определяют измерением показателя преломления, руководствуясь калибровочной кривой ref. Серийные измерения обычно начинают с наименьшей концентрации хв. После окончания измерения добавляют нижекипящий компонент в таком количестве, чтобы примерно получилось следующее значение концентрации; точно получать намеченную концентрацию нет необходимости - достаточно, чтобы она лежала вблизи желаемой точки измерения. [3]
Простейшим образом определение фазового равновесия может быть осуществлено в аппарате ( рис. 50), собранном из стандартных деталей по нормалям дестинорм. В испаритель 1 загружают 250 - 400 мл смеси и нагревают ее до кипения. По термометру наблюдают за изменением температуры. Одновременно отбирают пробу жидкости из испарителя. Измерения необходимо повторять несколько раз до получения при отборе пробы одинаковой концентрации три раза подряд. Для измерения при атмосферном давлении очень удобен прибор б для взятия пробы, работающий по принципу шприца. При определениях в вакууме применяют прибор для отбора проб ( см. рис. 103), пригодный также и при работе под атмосферным давлением, который позволяет избежать соприкосновения пробы со смазкой крана. Концентрацию определяют измерением показателя преломления, руководствуясь калибровочной кривой HQ-вес. Серийные измерения обычно начинают с наименьшей концентрации хв. После окончания измерения добавляют нижекипящий компонент в таком количестве, чтобы примерно получилось следующее значение концентрации; точно получать намеченную концентрацию нет необходимости - достаточно, чтобы она лежала вблизи желаемой точки измерения. [4]
Принципиально метод определения фазовых равновесий с помощью давления схождения не может не быть приближенным. В этом методе константы фазовых равновесий компонентов в многокомпонентной системе определяются как функции трех переменных: давления, температуры и давления схождения. Уменьшение числа переменных возможно лишь в результате каких-либо закономерностей, не имеющих общего, обязательного характера. Закономерности эти, как было упомянуто, при определенных условиях нарушаются. [5]
Данная работа посвящена определению фазового равновесия жидкость - пар трехкомпонентной составляющей концентрационного тетраэдра - метанол - пропанол - пропилацетат и определению разделяющей линии дистилляции. В литературе имеются данные по фазовому равновесию жидкость - пар в бинарных системах метанол - пропанол [ 2J и пропанол - пропилацетат L3 ], но данные по фазовому равновесию в системе метанол - пропилацетат и в тройной системе отсутствуют. [6]
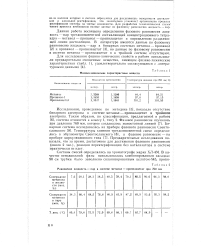 |
Равновесие жидкость - пар в системе метанол - пропилацетат при 760 мм. [7] |
Данная работа посвящена определению фазового равновесия жидкость - пар трехкомпонентной составляющей концентрационного тетраэдра - метанол - пропанол - пропилацетат и определению разделяющей линии дистилляции. В литературе имеются данные по фазовому равновесию жидкость - пар в бинарных системах метанол - пропанол [2] и пропанол - пропилацетат [3], но данные по фазовому равновесию в системе метанол - пропилацетат и в тройной системе отсутствуют. [8]
В технологической практике для определения фазового равновесия широко применяют диаграммы состояния, в которых какое-либо свойство системы, например температура плавления tnn или температура кипения 4-ип, находят как функцию состава. Диаграммы состояния строят на основе правила фаз обычно по опытным данным. При температуре, соответствующей кристаллизации расплава ( или плавлению твердого материала), замедляется скорость снижения ( или повышения) температуры за счет выделения ( или затраты) теплоты кристаллизации. На диаграмме охлаждения ( или нагрева) кривая t - f ( i) имеет плато в период кристаллизации или плавления. [9]
В технологической практике для определения фазового равновесия широко применяют диаграммы состояния, в которых какое-либо свойство системы, например, температура плавления tnjl или температура кипения 4ип, находят как функцию состава. Диаграммы состояния строят на основе правила фаз обычно по опытным данным. При температуре, соответствующей кристаллизации расплава ( или плавлению твердого материала), наблюдается замедление скорости снижения ( или повышения) температуры за счет выделения ( или затраты) тепла кристаллизации. На диаграмме охлаждения ( или нагревания) кривая t f ( т) имеет ступеньку в период кристаллизации или плавления. [10]
Для практических расчетов при определении фазового равновесия применяют диаграммы состояния, в которых какое-либо свойство системы, например температура плавления Тп или температура кипения Тк, определяется как функция состава. Диаграммы состояния строят по опытным данным на основе правила фаз. [11]
В - технологической практике для определения фазового равновесия широко применяют диаграммы состояния, в которых какое-либо свойство системы, например температура плавления tasi или темпертаура кипения кип, определяется как функция состава. [12]
Для неидеальных смесей эта формула используется при определении фазового равновесия компонентов с учетом активности в жидкой фазе и фугитивности в паровой. [13]
Найденные из термодинамики условия равновесия в дальнейшем будут использованы для определения фазового равновесия в гетерогенных и гомогенных системах. [14]
Значения подобных констант приводятся в литературе; ими можно пользоваться при определении фазового равновесия в системах, для которых отсутствуют экспериментальные данные. [15]
Страницы: 1 2