Определение - равновесное состояние
Cтраница 2
Величина у отличается от безразмерной величины у / Т линейным, но с добавком, несущественным при определении равновесных состояний. [16]
При проектировании вентиляционной системы, имеющей два или несколько вентиляторов, включенных в одну сеть, одной из задач является определение равновесного состояния системы, а следовательно, и режима работы каждого из вентиляторов. Поскольку характеристика давления вентилятора сложна и обычно задана графически в виде кривой p ( L), то наиболее простым способом анализа оказывается графический, для которого используют характеристики полного давления вентиляторов. [17]
В отличие от ионного обмена существенную роль при молекулярной адсорбции играет температура и не только в кинетике сорбции, но и в определении равновесного состояния, так как энергия взаимодействия при молекулярной адсорбции существенно уступает энергии электростатического взаимодействия ионов. С повышением температуры убывает количество адсорбированного вещества. [18]
В данной главе рассмотрены термодинамические функции, используемые при изучении фазового и химического равновесия, причем основное внимание уделено тем из них, которые важны для определения равновесного состояния и оценки изменения энергии, сопровождающего переход из одного равновесного состояния в другое. Однако детального описания всех уравнений, которые могут быть полезными при решении указанных задач, мы приводить не будем. Основные соотношения для наглядности сведены в таблицах, ряд таких таблиц помешен в приложении А. [19]
В данной главе рассмотрены термодинамические функции, используемые при изучении фазового и химического равновесия, причем основное внимание уделено тем из них, которые важны для определения равновесного состояния и оценки изменения энергии, сопровождающего переход из одного равновесного состояния в другое. Однако детального описания всех уравнений, которые могут быть полезными при решении указанных задач, мы приводить не будем. Основные соотношения для наглядности сведены в таблицах, ряд таких таблиц помещен в приложении А. [20]
Согласно правилу фаз трехкомпонентная двухфазная система обладает тремя степенями свободы. Это означает, что для определения равновесного состояния такой системы необходимо принять значения любых трех ее интенсивных свойств, тогда все остальные ее свойства в обеих фазах системы окажутся строго определенными. Интенсивными свойствами системы являются ее температура, общая и парциальная упругость паров ее компонентов, составы фаз. Правило фаз не накладывает никаких ограничений на выбор того или иного интенсивного свойства в качестве степени свободы и устанавливает лишь число этих свойств, которое должно быть зафиксировано для определенности состояния системы. Поэтому из перечисленных выше свойств системы теоретически вполне достаточно зафиксировать любые три, и равновесное состояние системы станет строго определенным и единственным. Однако с практической точки зрения целесообразно предоставляемый правилом фаз известный произвол в выборе независимых переменных использовать наиболее выгодным образом, выбрав в качестве фиксированных такие свойства, которые легче позволят рассчитать значения всех остальных свойств системы в обеих ее фазах. [21]
Поэтому значения температуры и давления должны быть постоянными и одинаковыми во всех фазах системы. Однако не во всех случаях этих двух условий достаточно для определения равновесного состояния системы; хотя необходимы они всегда. [22]
Если имеет место единственная реакция, количества всех присутствующих веществ связаны посредством сте-хиометрического уравнения, так что имеется только одна независимая переменная - скажем, превращение, выраженное в долях одного из компонентов. Поскольку химические потенциалы играют решающую роль в определении равновесных состояний, в практической работе необходимо располагать их численными значениями. Химические потенциалы являются функциями Т и Р, а также состава. Их оценка из измеренных избыточных свойств, например Gex, ff, P, упрощается при дифференцировании этих данных. Избыточную энергию Гиббса, например, обычно находят из парожидкостных и других данных о фазовом равновесии ( см. гл. [23]
Если имеет место единственная реакция, количества всех присутствующих веществ связаны посредством сте-хиометрического уравнения, так что имеется только одна независимая переменная - скажем, превращение, выраженное в долях одного из компонентов. Поскольку химические потенциалы играют решающую роль в определении равновесных состояний, в практической работе необходимо располагать их численными значениями. Химические потенциалы являются функциями Т и Р, а также состава. Их оценка из измеренных избыточных свойств, например Gex, Я, Vе, упрощается при дифференцировании этих данных. Избыточную энергию Гиббса, например, обычно находят из парожидкостных и других данных о фазовом равновесии ( см. гл. [24]
Принципы и методы, на которых основана теория ректификации бинарной системы, применимы и к разделению многокомпонентных систем, однако вследствие увеличенного числа переменных здесь это сопряжено со значительно большими трудностями. В самом деле, n - компонентная двухфазная жидко-паровая система согласно правилу фаз обладает п степенями свободы. В бинарной системе достаточно помимо давления, под которым ведется процесс, задать содержание какого-нибудь компонента в одной из фаз, чтобы состояние равновесной системы оказалось полностью определенным. Не так обстоит дело в сложной системе. Помимо постоянного внешнего давления здесь необходимо зафиксировать еще ( п - 1) других интенсивных факторов для определения равновесного состояния системы. [25]
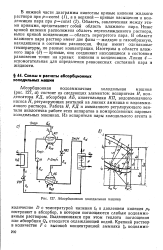 |
Абсорбционная холодильная машина. [26] |
Область, заключенная между этими кривыми, представляет собой область влажного пара. Ниже кривой кипения расположена область переохлажденного раствора, выше кривой конденсации - область перегретого пара. В области влажного пара раствор имеет две фазы - жидкую и газообразную, находящиеся в состоянии равновесия. Фазы имеют одинаковые температуры, но разные концентрации. Изотермы в области влажного пара ( 3) - прямые, они соединяют находящиеся в состоянии равновесия точки на кривых кипения и конденсации. Линия 4 - вспомогательная для определения равновесных состояний пара и жидкости. [27]
Главный вывод наших исследований при направленной кристаллизации солевых объектов - существование области равновесной кристаллизации при скорости кристаллизации, большей, чем минимальная скорость вытягивания, ниже которой скорость вытягивания не определяет скорости кристаллизации. Возникает естественный вопрос: справедлив ли этот вывод для полупроводниковых материалов. К сожалению, ответить на него сейчас невозможно из-за отсутствия соответствующих экспериментальных данных. Однако необходимо остановиться на следующем. В плане проведенных нами исследований равновесное состояние твердого тела можно определить как состояние, в котором примесь в сечении слитка ( на фронте кристаллизации) распределена однородно. Неравновесное же состояние твердого тела характеризуется неравномерным распределением примеси в сечении слитка. Если исходить из приведенного выше определения равновесного состояния твердого тела, проявление эффекта грани говорит о неравновесном состоянии. [28]
Страницы: 1 2