Определение - таллий
Cтраница 3
При определении таллия этим методом ионы тяжелых металлов не следует осаждать из рабочего раствора в виде гидроокисей при помощи едкой щелочи, так как при этом неизбежна потеря значительной части ионов таллия в результате сооса-ждения. При осаждении их в виде основных карбонатов не следует нагревать раствор с осадком перед фильтрованием потому что в результате нагревания усиливается гидролиз, приводящий к соосаждению и потере таллия. Фотометрирование растворов должно происходить по возможности быстро, так как при воздействии ультрафиолетовых лучей иодид калия разлагается с выделением элементарного иода, что увеличивает оптическую плотность раствора и может привести к завышению результатов. [31]
При определении таллия королек пробы весом - 250 мг помещают в кратер нижнего угольного электрода размером 4X2 мм. Вспомогательным электродом служит медный стержень диаметром 8 мм, заточенный на полусферу. Возбуждение спектра таллия проводится в дуге переменного тока при силе тока 2 а. Межэлектродный промежуток равен 2 мм, экспозиция 70 сек. Фотографирование проводится через круглую диафрагму на диапозитивных пластинках, чувствительностью 0 7 ед. [32]
При определении таллия королек пробы весом - 250 мг помещают Е, кратер нижнего угольного электрода размером 4X2 мм. Вспомогательным электродом служит медный стержень диаметром 8 мм, заточенный на полусферу. Возбуждение спектра таллия проводится в дуге переменного тока при силе тока 2 а. Межэлектродный промежуток равен 2 мм, экспозиция 7 0 сек. Фотографирование проводится через круглую диафрагму на диапозитивных пластинках, чувствительностью 0 7 ед. [33]
При определении таллия в качестве электролита используют 0 05 М раствор K4Fe ( CN) e в 2 М NaOH. Титрационную ячейку закрывают светонепроницаемой бумагой и ведут титрование в атмосфере азота. [34]
При определении таллия методом стандартных серий минимальная концентрация его составляет 0 5 мкг / мл; при определении по калибровочной кривой - 0 05 мкг / мл. [35]
При определении таллия в иодиде натрия следует иметь в виду, что анион иода с родамином С образует комплекс, который извлекается бензолом, при этом наблюдается флуоресценция экстракта. Для удаления иода были применены273 последовательно ряд операций: основную массу иода удаляли путем двухкратного кислотного разложения иодида натрия серной кислотой с прокаливанием и плавлением соли. [36]
Аналогично проводили определение таллия в металлическом цинке, но навеску растворяли в одной серной кислоте. [37]
Из методов определения таллия более подробно рассмотрены чувствительный экстракционно-фотометрический метод с применением родамина В и менее чувствительный иодокрахмальный метод, осуществляемый в водной среде. Заслуживают внимания также методы с применением родственных родамину В основных красителей. [38]
Предложена методика определения таллия в сульфате кадмия с использованием графитового ( тип I) и насыщенного каломельно. [40]
Комплексонометрический метод определения таллия также возможен, поскольку таллий ( III) образует прочный комплексо - Нат19 20 Однако особых преимуществ этот метод не имеет, так как он недостаточно избирателен. [41]
Метод рекомендуется для определения таллия при содержании его в сплаве в количестве 0 25 % и более. [42]
Метод применим для определения таллия в магниевых и прочих сплавах, содержащих не менее 0 5 % таллия в отсутствие мешающих элементов. [43]
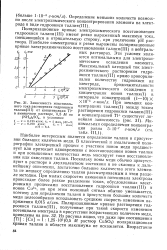 |
Зависимость максимального тока растворения гидроокиси таллия ( Ш от концентрации Т1 в аммиачном растворе, 0 5 М по ( NH4 2SO4, в условиях. [44] |
Наиболее интересным является определение таллия в присутствии больших количеств меди. В классической и амальгамной полярографии электродный процесс с участием ионов меди предшествует или протекает одновременно с восстановлением ионов таллия и при повышенных количествах медь маскирует токи восстановления или окисления таллия. Поскольку ионы меди обычно присутствуют в растворе в двухвалентном состоянии и не склонны к дальнейшему окислению, достаточно большие количества этого элемента не мешают определению таллия рассматриваемым в этом разделе методом. Поляризационные кривые растворения гидроокиси таллия ( III), полученные при такой скорости изменения потенциала электрода в присутствии возрастающих количеств меди, приведены на рис. 32, Из рисунка видно, что даже при соотношении [ Т1 ]: [ Си ] 1: 1 25 - 105 ( 0 5 М раствор CuSO4) поляризационная кривая таллия в области максимума не искажается. [45]
Страницы: 1 2 3 4