Бихромат
Cтраница 1
Бихромат реагирует с иодидом и кислотой также не мгновенно. Но в этом случае молибдат замедляет основную реакцию, индуцируя окисление иодида кислородом воздуха. Механизм реакции, невидимому, очень сложен, ибо свет оказывает на нее фотохимическое действие. В приведенной ниже табл. 36 показаны результаты некоторых опытов, иллюстрирующих сказанное. После стояния в течение 15 мин. [1]
Бихромат труднее, ( чам перманганат, восстанавливается органическими веществами. [2]
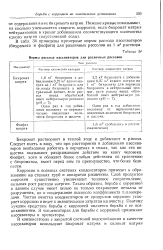 |
Нормы расхода пассиваторов для различных рассолов. [3] |
Бихромат растворяют в теплой воде и добавляют в рассол. Следует иметь в виду, что при растворении и добавлении пассиваторов необходимо работать в перчатках и очках, так как эти вещества оказывают раздражающее действие на кожу человека. Фосфат, хотя и обладает более слабым действием по сравнению с бихроматом, имеет перед ним то преимущество, что более безопасен. [4]
Бихромат в растворе серной кислоты часто используют при повышенных температурах для окисления органических соединений [55]: углеводородов, спиртов, эфиров, карбоновых кислот и альдегидов. Конечными продуктами окисления обычно являются вода и диоксид углерода. [5]
Бихромат является анионом приблизительно столь же сильной кислоты, как и кислоты, образуемые оксианионами MnO4, С1О4 или NOJ. Появление мостиковых связей X - О - X в результате потери молекул воды представляет собой довольно обычное явление при растворении оксианионов в кислых растворах, однако изолировать или даже идентифицировать подобный димер удается довольно редко. [6]
Бихромат - и перхлорат-ионы не мешают определению. [7]
Бихромат является одним из распространенных в органической химии окислителей. Химический способ, основанный на окислении хромита при 11СО - 1 - 150 кислородом воздуха, имеет ряд недостатков, к наиболее существенным из которых относятся многоступенчатость процесса, значительные удельные расходы сырья. [8]
 |
Нормы расхода пассиваторов для различных рассолов. [9] |
Бихромат растворяют в теплой воде и добавляют в рассол. Следует иметь в виду, что при растворении и добавлении пассиваторов необходимо работать в перчатках и очках, так как эти вещества оказывают раздражающее действие на кожу человека. Фосфат, хотя и обладает более слабым действием по сравнению с бихроматом, имеет перед ним то преимущество, что более безопасен. [10]
Бихромат весьма устойчив и не разлагается при нагревании до очень высоких температур. [11]
Бихромат отличается от других окислителей очень высокой устойчивостью. Он не окисляет случайных примесей органических веществ, как перманганат, и титр его раствора не меняется неопределенно долгое время, если только устранена возможность испарения воды. Вторым преимуществом бихромата является то, что его раствором можно титровать ионы железа ( II) в присутствии ионов хлора, которые бихроматом не окисляются. [12]
Бихромат и хромат калия дают с висмутом оранжево-красный или желтый осадок [ 1044 ( стр. Из слабоазотнокислого раствора висмут осаждается бихроматом калия количественно. [13]
 |
Нормы расхода пассиваторов для различных рассолов. [14] |
Бихромат растворяют в теплой воде и добавляют в рассол. Следует иметь в виду, что при растворении и добавлении пассиваторов необходимо работать в перчатках и очках, так как эти вещества оказывают раздражающее действие на кожу человека. Фосфат, хотя и обладает более слабым действием по сравнению с бихроматом, имеет перед ним то преимущество, что более безопасен. [15]
Страницы: 1 2 3 4