Ss-электрон
Cтраница 2
В процессе ионизации Na-Na атом натрия теряет внешний Ss-электрон и приобретает замкнутую электронную оболочку инертного газа неона. [16]
Пятифтористый фосфор образуется путем разделения холостой пары Ss-электронов. [17]
Поэтому при возбуждении атома фосфора один из Ss-электронов может переходить на Sd-орбиталь. Следовательно, атом фосфора в основном состоянии может быть трехвалентным, в возбужденном - иметь пять неспаренных электронов и выступать как пятивалентный элемент. Аналогичное распределение электронов по подуровням имеют мышьяк, сурьма и висмут. [18]
Для оптической спектроскопии наибольший интерес представляют переходы валентного Ss-электрона атома натрия. В этом случае побочное квантовое число / может принимать значения О, 1, 2, что отвечает s -, p - и d - орбиталям. [19]
 |
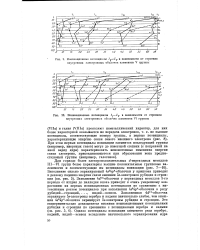
График радиального распределения вероятности в атоме натрия. [20] |
К - и L-слоев; 2 i для Ss-электрона; 3 - для Зр-электрона. [21]
Здесь член - Н соответствует прямому вкладу в сдвиг от Ss-электронов, участвующих в связи, тогда как следующий член отражает увеличение плотности ( 2 - hs) оставшихся электронов, пропорциональное общему числу отданных на связь электронов; при этом экранирующий эффект для 5s - и 5р - электронов принимается равным. Это не противоречит величине, полученной при анализе изотопного эффекта. Было также найдено, что величину у неправильно считать константой для всего набора ионизированных состояний от s3pe до s p, хотя очевидно, что многократно ионизированные атомы не существуют в реальных химических связях. [22]
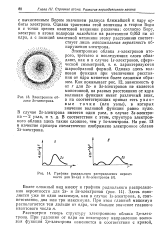 |
Электронное облако 2-электрона.| Графики радиального распределения вероятности для 2s - ( a и Зз-электронов ( б. [23] |
Как показывает рис. 12, зависимость тр от г для 2s - и Ss-электронов не является монотонной, на разных расстояниях от ядра волновая функция имеет различный знак, а на соответствующих кривых есть у з л о вые точки ( или узлы), в которых значение волновой функции равно нулю. [24]
Отличия между изомерными сдвигами в различных соединениях иода определяются в первую очергдь электронной плотностью внешних Ss-электронов. Следует отметить, что плотность Ss-электронов в области ядра сильно зависит от относительного вклада 5р - и Ss-электронов в образование связи атома иода с атомами лигандов. При увеличении числа 5р - электронов общая s - электронная плотность должна уменьшаться вследствие усиления экранирования Ss-электронов. [25]
Если считать, что 65-электроны свинца не участвуют в связи так же, как и Ss-электроны атома серы, то связь в PbS осуществляется за счет бр-электронов атома РЬ и Зр-электронов атома S - всего шести электронов на пару атомов А, В. [26]
 |
Электронные оболочки алюминия, скандия, иттрия и лантана. [27] |
В нормальном состоянии наружный энергетический уровень атома алюминия содержит три электрона, из которых при возбуждении один парный Ss-электрон перейдет на свободную р-орбиталь. [28]
У натрия, стоящего в периодической системе элементов вслед за неоном и начинающего третий период, появляется один Ss-электрон, а у магния - два таких электрона. Обычно в обозначении электронных структур атома опускают обозначения целиком заполненных внутренних оболочек и записывают лишь формулу наружной оболочки. [29]
Страницы: 1 2 3 4 5