Блокировка - поверхность
Cтраница 2
Участки / / соответствуют резкому1 падению скорости процесса растворения вследствие блокировки поверхности металла, например, малорастворимым PbSO4; участки / / / характеризуют установившуюся скорость растворения металла в состоянии пассивности и быстрый рост потенциала при малом увеличении скорости. [16]
 |
Устойчивость никель-хромового катализатора в процессе гидрирования сульфолена-3. [17] |
Более вероятно, что металлический катализатор теряет активность в результате блокировки поверхности ядами, образующимися в процессе гидрирования. Вследствие способности атомов кислорода ЗСЬ-груп-пы сульфона образовывать связи с металлом или носителем металла [235, 247] возможно ослабление и без того слабой связи С - S и ее разрыв. [18]
Под отравлением понимается химическая дезактивация катализатора, отличающаяся от таковой механической из-за блокировки поверхности, например коксом, и термической, например из-за спекания. Отравление является следствием связывания активных центров поверхности катализатора ядом путем адсорбции, химического взаимодействия или перестройки структуры поверхности. Яд или его предшественник ( соединение, из которого он получается реакцией с поверхностью) могут привноситься извне в виде примеси к реакционному потоку или образовываться в ходе самого каталитического процесса в результате побочных реакций либо даже основной реакции. [19]
Реакции, в которых участвуют катионы, замедляются в результате - эффекта и блокировки поверхности. [20]
Замедление процесса Ме-Ме при образовании адсорбционного слоя кислорода обусловлено в некоторых случаях не столько блокировкой поверхности электрода, сколько изменением строения двойного слоя. При помощи весьма тонких экспериментов Б. В. Эршлер обнаружил, что скорость анодного растворения платины в соляной кислоте уменьшается в 10 раз, если количество атомов адсорбированного кислорода составляет 6 % от количества атомов платины на поверхности электрода. Если, следовательно, 6 % поверхности закрыто адсорбированным кислородом, то скорость анодного растворения платины уменьшается в 10 раз. Закрытие 12 % поверхности уменьшает скорость растворения в 100 раз; закрытие каждых следующих 6 % поверхности уменьшает скорость в 10 раз. [21]
Замедление процесса Ме-Ме при образовании адсорбционного слоя кислорода обусловлено в некоторых случаях не столько блокировкой поверхности электрода, сколько изменением строения двойного слоя. [22]
Параметр п характеризует интенсивность уменьшения поверхности вяжущего как за счет растворения, так и вследствие блокировки поверхности цементного зерна продуктами гидратации. Для частиц одинакового размера и формы п 2 / 3, если они не покрываются новообразованиями. [23]
Замедление процесса Me - Me при образовании адсорбционного слоя кислорода обусловлено в некоторых случаях не столько блокировкой поверхности электрода, сколько изменением строения двойного слоя. При помощи весьма тонких экспериментов Б. В. Эршлер обнаружил, что скорость анодного растворения платины в соляной кислоте уменьшается в 4 раза, если количество атомов адсорбированного кислорода составляет 6 % от количества атомов платины на поверхности электрода. Если, следовательно, 6 % поверхности закрыто адсорбированным кислородом, то скорость анодного растворения платины уменьшается в 4 раза. Закрытие 12 % поверхности уменьшает скорость растворения в 16 раз; закрытие каждых следующих 6 % поверхности уменьшает скорость в 4 раза. [24]
Действие поверхностно-активных ингибиторов анионного типа в кислых средах обусловлено тормозящим эффектом, вызванным в первую очередь блокировкой поверхности корродирующего металла, при которой адсорбция анионов нередко сопровождается установлением химической связи между ними и поверхностными атомами металла, хотя при этом смещение потенциала максимума электрокапиллярных кривых в отрицательном направлении свидетельствует о таком изменении структуры двойного электрического слоя, которое должно бы приводить к ускорению коррозионного процесса. Чтобы значительно перекрыть отрицательное воздействие двойнослойного эффекта, необходимо гораздо большее заполнение поверхности металла ингибитором. В противном случае при введении таких ингибиторов общая коррозия может перейти в локальную. [25]
ДИП 10 - 4 М растворов S2 - и I - менее воспроизводимы, чем НИП, из-за блокировки поверхности ртутного электрода нерастворимыми продуктами его окисления. Резкое увеличение тока на НИП раствора S2 - начинается с точки излома, что соответствует теоретической форме волны при диффузионном контроле образования нерастворимого продукта. [26]
Действие органических молекул и ионов сказывается на кинетике стадии разряда - ионизации через изменение г - потенциала и через блокировку поверхности. [27]
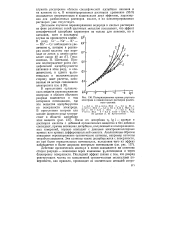 |
Поляризационные кривые ртутного электрода в подкисленных растворах различного состава. [28] |
Действие органических молекул и ионов сказывается на кинетике стадии разряда - ионизации через изменение г) гпотенциала и через блокировку поверхности. [29]
Действие органических молекул и ионов сказывается на кинетике стадии разряда - ионизации через изменение г - потенциала и через блокировку поверхности. [30]
Страницы: 1 2 3 4