Принцип паули
Cтраница 2
Принцип Паули запрещает, чтобы третий электрон находился на уже заполненной двумя электронами lj - орбнтали, и поэтому третий электрон занимает следующую орбнталь низшей энергии. Попадет ли электрон на 2s - или на одну из трех 2р - орбнталей. [16]
Принцип Паули лежит в основе объяснения структуры атомов и периодического закона Менделеева. Действительно, представьте себе, что ничто не мешает произвольному числу электронов находиться в одном состоянии. В любом атоме все электроны оказались бы на самом нижнем энергетическом уровне. [17]
Принцип Паули столь важен, что хотелось бы показать, как он выводится из антисимметрии волновой функции. Пусть греческие буквы а и / 3 обозначают состояния, а арабские числа 1 и 2 - набор четырех величин ( трех координат и проекции спина) каждая. [18]
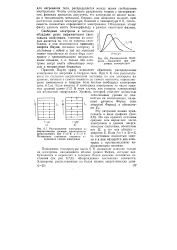 |
Распределение электронов по ero 2f а по оси абсцисс - энергетическим уровням ( схематическое гг с t 1 о о. [19] |
Принцип Паули сразу позволяет объяснить распределение-электронов по энергиям в твердом теле. При О К они располагаются по ступеням энергетической лестницы по два электрона на. [20]
Принцип Паули объясняет не только особенности тепловых свойств электронного газа, но и сам факт разделения кристаллов на металлы и диэлектрики. В чем же заключается принципиальное различие между этими двумя типами кристаллов и какую роль играет при этом принцип Паули. Сперва попытаемся выяснить, что происходит при объединении отдельных атомов в единый кристалл. [21]
Принцип Паули разрешает находиться в таком состоянии двум частицам с антипараллельными спинами и не разрешает находиться двум частицам с параллельными спинами. Следовательно, две частицы с данным импульсом р могут подойти друг к другу на расстояние а в том случае, когда их спины антипараллельны, и не могут сблизиться на такое расстояние, если их спины направлены одинаковым образом. [22]
Принцип Паули запрещает пребывание в. [23]
Принцип Паули применим к системе любых одинаковых элементарных материальных частиц, но он не применим к фотонам, так как для них. [24]
Принцип Паули, лежащий в основе систематики заполнения электронных состояний в атомах, позволяет объяснить Периодическую систему элементов Д. И. Менделеева ( 1869) - фундаментального закона природы, являющегося основой современной химии, атомной и ядерной физики. [25]
Принцип Паули ( или принцип антисимметрии) в квантовомехани-ческом понимании устанавливает, что электроны, имеющие один и тот же спин, не могут одновременно находиться в одной и той же области пространства потому, что полная волновая функция Т, представляющая истинное состояние системы, содержащей два или более электронов, должна стать антисимметричной при перестановке электронов. Иначе говоря, если для любых двух электронов поменять координаты ( три пространственные и спин), то волновая функция должна изменить свой знак. Принцип Паули не может быть доказан теоретически, однако он подтверждается выводами, которые делаются на его основе. [26]
Принцип Паули: в атоме не может быть двух электронов в состояниях, характеризующихся четырьмя одинаковыми квантовыми числами. [27]
Принцип Паули в его полном кванто вомеханическом истолковании связан с важным положением квантовой механики о неразличимости тождественных частиц и вытекающими из него следствиями. I, § 11.5), мы касались вопроса о том, что в квантовых статистиках в отличие от классической статистики учитывается неразличимость тождественных частиц. Когда в квантовой статистике решается вопрос о распределении частиц по ячейкам фазового пространства, то перемена местами двух тождественных частиц, например двух электронов, не приводит к новому распределению. [28]
Принцип Паули выражает особенность поведения системы тождественных фермионов: в. Из этой общей формулировки принципа Паули вытекает как частный случай его простейшая формулировка, приведенная выше. [29]
Принцип Паули есть проявление правила антисимметрии. Если бы два электрона в атоме имели одни и те же четыре квантовых числа, это означало бы, что они имеют одни и те же пространственные и спиновые функции. Другими словами, две спин-орбитали будут одинаковы и, следовательно, будут совпадать две строки детерминанта. [30]
Страницы: 1 2 3 4