Принцип паули
Cтраница 3
Принцип Паули связан с тождественностью электронов и с тем, что спин электрона - полуцелый. Тот же принцип можно сформулировать на координатном языке: в одной точке не может находиться более одного электрона с данным направлением спина. [31]
 |
Образование химических связей по обменному механизму в молекулах. 4 ( а и HaS ( б. [32] |
Принцип Паули запрещает использование одной и той же АО дважды в образовании химических связей. В этом и заключается насыщаемость ковалентной связи. [33]
Принцип Паули определяет распределение электронов по этим состояниям. [34]
Принцип Паули является эмпирическим и до сих пор еще не получил ясного теоретического объяснения. Предложено много его формулировок, например: а) в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы; б) одна атомная орбиталь может быть занята не более чем двумя электронами, которые должны иметь противоположные спины; в) волновая функция многоэлектронного атома должна быть антисимметричной по отношению к перестановке координат любых двух электронов; г) любые два электрона в атоме должны различаться значениями по крайней мере одного квантового числа. [35]
Принцип Паули определяет прежде всего максимальную емкость по электронам одной орбитали Nn. [36]
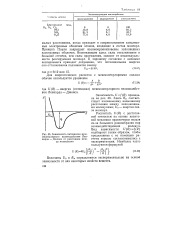 |
Зависимость потенциала межмолекулярного взаимодействия Лен-нарда - Джонса от расстояния между молекулами. [37] |
Принцип Паули запрещает взаимопроникновение заполненных электронных оболочек. [38]
Принцип Паули весьма естественно объясняет первые три из магических чисел. Для объяснения следующих чисел этого ряда необходим ряд дополнительных предположений. [39]
Принцип Паули имеет еще одно важное следствие, предсказывая, что ядра, образованные четным числом протонов и четным числом нейтронов, будут обладать особенно высокой стабильностью. Данной совокупности квантовых чисел, характеризующих состояния частиц в пространстве, могут отвечать только два протона и два нейтрона со спинами, направленными противоположно друг другу. Совокупность двух протонов и двух нейтронов представляет собою подобие завершенной подоболочки. Особенно высокой стабильности ядер следует ожидать в тех случаях, когда нуклоны характеризуются одинаковыми пространственными координатами. Это возможно в случае, если количество протонов и нейтронов в ядре одинаково. [40]
Принцип Паули учитывается в промежуточных состояниях. Как следствие этого Бете нашел, что потенциалы с достаточно хорошим поведением дают матрицу рассеяния, которая по существу является матрицей рассеяния для потенциала взаимодействия между двумя нуклонами. Это утверждение не распространяется на потенциалы с отталкивающими сердцевинами. [41]
Принцип Паули говорит о том, что одними и теми же величинами всех четырех квантовых чисел ( п, I, mt и ms) в оболочке данного атома может характеризоваться только один единственный электрон. Для любого другого электрона в той же оболочке должно быть иным значение хотя бы одного из квантовых чисел. [42]
Принцип Паули весьма естественно объясняет первые три из магических чисел. Для объяснения следующих чисел этого ряда необходим ряд дополнительных предположений. [43]
Принцип Паули имеет еще одно важное следствие, предсказывая, что ядра, образованные четным числом протонов и четным числом нейтронов, будут обладать особенно высокой стабильностью. Данной совокупности квантовых чисел, характеризующих состояния частиц в пространстве, могут отвечать только два протона и два нейтрона со спинами, направленными противоположно друг другу. Совокупность двух протонов и двух нейтронов представляет собою подобие завершенной подоболочки. Особенно высокой стабильности ядер следует ожидать в тех случаях, когда нуклоны характеризуются одинаковыми пространственными координатами. Это возможно в случае, если количество протонов и нейтронов в ядре одинаково. [44]
Принцип Паули ( запрет Паули) позволяет определить емкость атомной орбитали и квантового слоя в целом. Согласно этому принципу в атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел. Два любых электрона в атоме должны отличаться но крайней мере значениями одного квантового числа. [45]
Страницы: 1 2 3 4