Пентафторид - бром
Cтраница 1
Пентафторид брома реагирует со взрывом при контакте с водой и некоторыми сортами стекла. [1]
Пентафторид брома изучен значительно менее трифто-рида, но хорошо известно, что по своей окислительной способности по отношению к металлам, простым неорганическим и органическим соединениям превосходит другие фториды брома. [2]
Пентафторид брома был получен Руффом и Менделем [1] в 1931 г. двумя методами. По первому методу предварительно получали трифторид брома взаимодействием элементов при 0 С, а затем пентафторид брома реакцией стехиометрических количеств паров BrF3 и фтора при 200 С. [3]
Пентафторид брома в чистом состоянии при комнатной температуре - совершенно бесцветная жидкость [1]; на воздухе сильно дымит. Продукты гидролиза могут растворяться в BrFF, придавая ему окраску от бледно-желтой до темно-красной. [4]
Пентафторид брома реагирует с большинством металлов. Реакция BrF5 с барием, цинком, ртутью, порошком бора, аморфным углеродом, порошкообразным литием, красным фосфором, мышьяком, сурьмой, молибденом, вольфрамом, порошком серы, селеном и теллуром, иодом, иридием, порошкообразным железом и кобальтом начинается практически мгновенно, без внешнего подогрева ( часто с появлением пламени [1]) с образованием соответствующих высших фторидов элементов. Поверхность ртути при воздействии BrF5 покрывается коричневатой пленкой. При действии на кипящую ртуть образуются белый бромид и желтый фторид ртути. Реакция с висмутом, марганцем и порошкообразным алюминием, никелем, родием начинается при слабом нагревании и сопровождается раскаливанием металлов. Кадмий, хром, порошок титана и платиновая фольга начинают реагировать с BrF5 при накаливании до темно-красного цвета. Свинец реагирует при 300 С, а олово - при температуре плавления. [5]
Пентафторид брома был рассмотрен в разделе о фторидах с низкими энергиями связи. К той же группе фторидов принадлежат гексафториды, перечисленные в левой колонке табл. 6 с типом симметрии Oh. Из оставшихся фторидов с координационным числом 6 только гексафторид серы и пентафторид иода могут иметь практическое значение вследствие их доступности. Умеренный термодинамический потенциал реакции фторирования гексафторидом серы несколько скрадывается медленным течением реакции. Энергии активации для этих реакций очень высоки по причинам, которые уже обсуждались на примере че-тырехфтористого углерода. [6]
Производство пентафторида брома в широких пределах не налажено, его получение обеспечивается непосредственным взаимодействием элементов. [7]
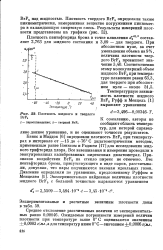 |
Плотность жидкого и твердого BrF5. [8] |
Плотность пентафторида брома в точке плавления d 81 3 составляет 2 763 для жидкого состояния и 3 09 - для твердого. [9]
В США пентафторид брома является промышленным продуктом. Его производят по способу Руффа и Менцеля [1 ] прямым взаимодействием элементов при 200 - 300 С. Обычно технический продукт подвергается очистке в кварцевой или металлической аппаратуре. [10]
Реакция гидролиза пентафторида брома протекает также с выделением свободного кислорода. В продуктах реакции обязательно содержится фтористый водород и, возможно, бромистово-дородная, бромноватистая и бромноватая кислоты. Схема гидролиза BrF5, приведенная Руффом и Менцелем [18], не совсем оправдана. [11]
Величина теплоты парообразования пентафторида брома составляет 7 31 ккал - моль-1, а молярная энтропия парообразования ( константа Трутона) равна 23 3 эн. [12]
Опытные данные о реакциях пентафторида брома немногочисленны и в основном носят качественный характер. Спирты предельного ряда, бензол, толуол взаимодействуют с жидким пентафторидом брома со взрывом: В паровой фазе реакция с этим веществом протекает спокойно с выделением пламени. Уксусная кислота с жидким BrF5 горит. Корковая пробка, пицеин, вата, бумага, ткани мгновенно воспламеняются. Жиры реагируют иногда с воспламенением и взрывом. Резина после взаимодействия становится хрупкой. Не приводя экспериментальных данных, Марей [58] утверждает, что пентафторид брома как фторирующий реагент мало отличается от трифторида брома; в обоих случаях присоединение фтора к двойным связям хлорпроизводных олефинов происходит легче, чем брома. [13]
 |
Установка для получения BrFs. [14] |
Хепворт и Робинсон [4] получали пентафторид брома, пропуская смесь паров брома и фтора через никелевую трубку, нагретую до 200 С. [15]
Страницы: 1 2 3 4