Перегиб - кривая - титрование
Cтраница 2
Отметим, что в рассмотренных случаях концентрация X в точке эквивалентности соответствует точке перегиба кривой титрования - эти точки расположены посредине скачка и показаны на рисунках. [16]
Если разбавлением титруемого раствора титрантом в процессе титрования можно пренебречь, то точка перегиба кривой титрования, соответствующая максимальному наклону кривой, практически совпадает с точкой эквивалентности. Это имеет важное значение в потенциометрическом титровании, где конечная точка титрования определяется как точка перегиба на экспериментальной кривой титрования. Чем больше изменение объема раствора в ходе титрования и чем ниже устойчивость комплекса MY, тем больше различие между точкой эквивалентности и точкой перегиба, которая смещается в сторону меньших количеств титранта. Если, условная константа устойчивости PMY уменьшается до некоторого предельного значения ( Эму) мин, то точка перегиба полностью исчезает. [17]
В данном способе, как и в предыдущем, точка эквивалентности устанавливается по перегибу кривой титрования, однако, щ отличие от способа А, здесь речь идет не о двукратном, а об Однократном перегибе. Существуют три разновидности этого способа. [18]
Точку эквивалентности, - как видно из предыдущей главы, - можно определить кик точку перегиба кривой титрования. [19]
Особенно это относится к титрованию не до определенного значения рН, а при нахождении точки эквивалентности по перегибу кривой титрования, когда зачастую обращают внимание лишь на потенциал, но не на рН раствора. [20]
Поэтому после точки эквивалентности сила тока, соответствующая восстановлению или окислению на электроде иона титранта, может быть значительной, и перегиб кривой титрования в эквивалентной точке будет резким, несмотря на малую концентрацию титруемого иона. [21]
Окислительно-восстановительные реакции в большинстве случаев протекают в сильно кислой среде; небольшие изменения электропроводности за счет реакции окисления-восстановления на фоне высокой проводимости среды обусловливают нерезкие перегибы кривой титрования в конечной точке. Это приводит к значительным ошибкам в определении конечной точки. В работе [69] систематизированы реакции этого типа в наглядной таблице для целей кондуктометрического титрования. Эта таблица может быть использована при разработке методов ВЧ-титрования окислителей и восстановителей. [22]
 |
Типичная кривая. [23] |
Vj / Vj) ( а / 2); при этом оттитрована половина Redj. Следовательно, по точке перегиба кривой титрования может быть приближенно оценено значение стандартного потенциала окислительно-восстановительной системы. Более точная оценка требует учета коэффициентов активности. [24]
 |
Кривая высокочастотного кондуктометрнческого титрования ( слабая кислота - слабое основание. [25] |
Затем производится пуск реверсивного электродвигателя 7, который приводит в действие автоматическую бюретку. Процесс титрования заканчивается в точке перегиба кривой титрования. [26]
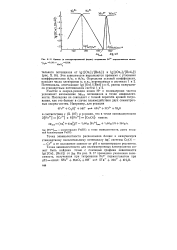 |
Кривая ( в линеаризированной форме титрования Ре2 перманганатом калия. [27] |
Участие в оксред-реакции ионов Н и полиядерных частиц усложняет нахождение Дфэкв потенциала в точке эквивалентности. Последняя не совпадает с точкой перегиба кривой титрования, как это бывает в случае взаимодействия двух симметричных оксред-систем. [28]
Вычерчивают кривую титрования, откладывая на оси ординат показания потенциометра в милливольтах или в единицах рН, а на оси абсцисс - объем добавленного раствора в кубических сантиметрах. За точки эквивалентности принимают точки перегиба кривой титрования, которые, как правило, находятся вблизи потенциалов, соответствующих буферных растворов. [29]
Титрование очень разбавленных растворов кислот или оснований с использованием цветного индикатора часто невозможно или связано с большой ошибкой. Потенциометрическое определение точки эквивалентности по перегибу кривой титрования в зтом случае также дает значительную ошибку вследствие того, что вблизи точки эквивалентности на величину рН раствора влияют различные побочные процессы, например, диссоциация обычно присутствующей в растворе угольной кислоты. [30]
Страницы: 1 2 3 4 5