Перегруппировка - электрон
Cтраница 1
Перегруппировка электронов и образование того или иного вида химической связи определяются соотношением величины сродства к электрону и электроотрицательности атомов, вступающих в связь. [1]
В медных комплексах подобная благоприятная перегруппировка электронов невозможна. Медные комплексы в основном не принимают более четырех азотистых радикалов, другие два координационных положения занимают молекулы воды. Более сильное взаимодействие кетонов с медным альдиминовым комплексом сложнее объяснить, поскольку окисленные радикалы не вызывают магнитного перемещения в никелевых комплексах. Возможно, что при этих обстоятельствах оба комплекса реагируют только с одним радикалом молекулы. [2]
Электроотрицательность имеет значение при определении результатов возможной перегруппировки электронов при взаимодействии атомов. Пусть взаимодействуют атомы А и В. Энергия, выделяющаяся при переходе электрона от атома А к атому В, равна разности между электронным сродством Ев атома В и ионизационным потенциалом IА атома А. При переходе электрона в противоположном направлении выделяющаяся энергия равна разности между электронным сродством Ев атома А и ионизационным потенциалом IA атома В. Обычно за меру э.о. принимают полусумму ионизационного потенциала и электронного сродства, обозначают ее через х и выражают в электроновольтах на атом. [3]
Таким образом, речь идет о перегруппировке электронов, участвующих в образовании связей и разрыве одной двойной связи. [4]
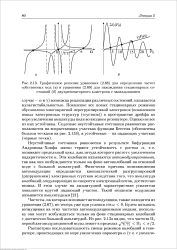 |
Графическое решение уравнения для определения частот собственных мод ( а и уравнения для нахождения стационарных состояний ( б двухрезонаторного клистрона с запаздыванием. [5] |
Появление все новых стационарных режимов обусловлено многократной перегруппировкой электронов ( появлением новых электронных структур ( сгустков)) в пространстве дрейфа по мере увеличения амплитуды поля во входном резонаторе. [6]
Согласно теории электронной таутомерии, в молекуле происходят непрерывные перегруппировки электронов, вызывающие ее превращение из одной формы в другую. Эти качественно отличные друг от друга формы молекулы и называются нами электронно-таутомерными структурами. Теория электронной таутомерии показывает, что каждая перегруппировка электронов в молекуле устанавливает новый характер взаимодействия се атомных ядер и электронов, новый характер взаимных влияний атомов, новое химическое строение. [7]
Для того чтобы рассматривать химические реакции с точки зрения перегруппировки электронов, необходимо знать расположение электронов в атоме любого элемента относительно его ядра. В главе XXIII мы более подробно остановимся на этом вопросе, а сейчас познакомимся только с главными законами строения атома. [8]
Физический механизм хемосорбции, подобно образованию химических соединений, обусловлен перегруппировкой электронов взаимодействующих частиц. Важнейшими формами таких перегруппировок являются либо передача одного или большего 4i ч электронов от одного из атомов другому, либо смещение э - нов в направлении к одному из атомов, причем большей частькЗ при этом образуются электронные пары, общие для взаимодействующих частиц и связывающие их между собой. Возникающая связь по типу подобна ковалентной, ионной, донорно-акцепторной, либо носит промежуточный между ними характер. [9]
Отсюда следует, что для электроокисления веществ, склонных к окислению путем перегруппировки электронов, совершенно необходимо подобрать такие условия, которые создали бы для выделения кислорода большее перенапряжение и затруднили его образование настолько, насколько это необходимо для того, чтобы процесс электроокислепия при помощи электронной перегруппировки сделался бы преобладающим или даже практически единственным. [10]
Большую роль в приборах О-типа играют нелинейные эффекты, в частности насыщение мощности вследствие перегруппировки электронов. [11]
В обоих случаях низшие электронные состояния заняты полностью; валентные электроны упорядочены, и перегруппировка электронов ( или их движение в электрическом поле) невозможно. [12]
Узкие полосы у элементов с d - электронами могут появиться в том случае, если перегруппировки электронов не затрагивают связывающие или разрыхляющие орбиты и не приводят к изменению расстояний между центральным атомом и лигандом ни в нормальном, ни в возбужденном состояниях. [13]
 |
Образование молекулы NaCl из атомов. [14] |
Атомы имеют свойство соединяться друг с другом и образовывать молекулы, при этом происходит некоторая перегруппировка электронов. [15]
Страницы: 1 2 3 4