Большинство - аминокислота
Cтраница 1
Большинство аминокислот устойчиво в водных растворах и выдерживает кратковременное автоклавирование ( до 2 часов) при температуре 100 - 200 без заметного разложения. Исключение составляют глютаминовая кислота и глютамин, которые при этих условиях претерпевают циклизацию. [1]
Большинство аминокислот имеют только один асимметрично расположенный атом углерода и могут образовывать два возможных оптических изомера - D ( право) и L ( лево), вращающих луч проходящего через них света. Аминокислоты биологического происхождения, находимые в ископаемых геологических объектах, представлены L-изомерами, в то время как аминокислоты, синтезированные неорганическим ( не биологическим) путем, представляют собой смеси оптических изомеров ( L и D в равных количествах) и потому оптически не активны. [2]
Большинство аминокислот, входящих в состав белков, имеют формулу R - СН-СООН. [3]
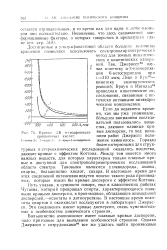 |
Кривые ДВ а - ( иодфенокси. [4] |
Большинство аминокислот имеет плавные кривые дисперсии, мало пригодные для выявления особенностей строения. [5]
Большинство аминокислот синтезируется в организме животных и человека, однако некоторые из них не образуются в организме и должны поступать с пищей извне. [6]
Большинство аминокислот можно легко превратить в их грет-бутилоксикарбонилпроизводные. Осложнения возникали лишь в случае аспарагиновой и глутаминовой кислот. Удалось также провести синтез № - трет-бутилоксикарбонил - №, № - дикарбобензокси - [866], Na-трег-бутилоксикарбонил - № - тозил - [1785] и № 1-трег-бутилокси - карбонил - М - нитропроизводных [10206] аргинина. Ацилирование оксиаминокислот протекает с низким выходом. [7]
Большинство аминокислот или свободного а-аминного азота сусла высвобождается при солодоращении, а не при затирании, но расщепление белков в ходе затирания продолжается и проходит две стадии. На первой стадии они растворяются, после чего происходит гидролиз до пептидов, которые по ходу протеолиза уменьшаются в размерах. По разным оценкам, в обычном солодовом сусле около 60 % всех белковых веществ присутствует в виде аминокислот, 20 % - в виде пептидов, а еще 20 % представляют собой полипептиды с высокой молекулярной массой, способные вызывать в пиве образование мути. [8]
Большинство аминокислот, участвующих в биохимических превращениях, содержит первичную аминогруппу, находящуюся в а-положении по отношению к карбоксильной функции. Во всех природных аминокислотах, входящих в состав белков ( за исключением глицина), углеродный атом в а-положении является центром асимметрии и аминокислоты принадлежат L-ряду, что соответствует приведенной ниже проекционной формуле ( см. также 1, стр. [9]
Большинство аминокислот практически не поглощает свет в доступной для регистрации области, так что их приходится окрашивать нингидрином. Этот метод окраски будет подробно рассмотрен в приложении 2, посвященном аминокислотным анализаторам. Пептиды и белки поглощают свет в области 206 - 215 нм за счет лептидной связи и в широкой области спектра с максимумом вблизи 280 нм за счет присутствия в них ароматических аминокислот. Азотистые основания и нуклеиновые кислоты хорошо поглощают вблизи 260 нм. Поэтому не удивительно, что основной метод детектирования в хроматографии белков и нуклеиновых кислот - это регистрация поглощения света в ультрафиолетовой области спектра. [10]
Большинство аминокислот - бесцветные кристаллические вещества, обычно хорошо растворимые в воде, часто сладковатые на вкус. Они, например, образуют соли в реакциях как с кислотами, так и со щелочами. [11]
Большинство аминокислот, образовавшихся при переваривании белков пищи, всасывается в кровь стенкой кишечника, но некоторая часть их избегает всасывания, так как подвергается ряду превращений за счет действия ферментов микроорганизмов кишечной флоры. [12]
Большинство аминокислот - бесцветные кристаллические вещества, обычно хорошо растворимые в воде, часто сладковатые на вкус. [13]
Большинство аминокислот, участвующих в биохимических превращениях, содержит первичную аминогруппу, находящуюся в а - Положении по отношению к карбоксильной функции. Во всех природных аминокислотах, входящих в состав белков ( за исключением глицина), углеродный атом в а-положении является центром асимметрии, и аминокислоты принадлежат ь-ряду, что соответствует приведенной ниже проекционной формуле ( см. также 1, разд. [14]
Большинство аминокислот поступает в воротную систему печени в виде свободных аминокислот. Только очень незначительная их доля проходит через кишечную стенку в виде пептидов или даже белков. [15]
Страницы: 1 2 3 4