Большинство - аминокислота
Cтраница 3
Основная масса азота большинства аминокислот проходит в реакциях обмена через стадии превращений в глютаминовую и аспарагиновую кислоты или а-аланин. Кроме того, в процессах обмена в животных тканях указанные аминокислоты возникают из других аминокислот. Так, глютаминовая кислота образуется из пролина, оксипролина, орнитина и гистидина; аланин образуется из триптофана, цистина, оксипролина и, вероятно, из серина. Количество этих аминокислот, объединяемых системой дикарбоновых аминокислот, составляет также около 25 - 30 % белковой молекулы. В результате около 50 - 60 % белковой молекулы составляют: аспарагиновая кислота, аланин, глютаминовая кислота и аминокислоты, связанные с ними прямым переходом в обмене. [31]
Свободные грет-бутиловые эфиры большинства аминокислот представляют собой устойчивые жидкости, перегоняющиеся без разложения. Они не претерпевают самоконденсации [48] даже при хранении при комнатной температуре ( о самоконденсации rper - алкиловых эфиров глицина см. [2395]); это является еще одним достоинством трег-бутиловых эфиров в дополнение к их способности легко расщепляться под действием кислот. Они весьма устойчивы к гидразинолизу и аминолизу [48] и значительно труднее омыляются щелочью, чем соответствующие метиловые и этиловые эфиры. Благодаря этим ценным свойствам грег-бутиловых эфиров их введение в химию пептидов значительно расширило возможности синтеза пептидов, содержащих, в частности, остатки аминодикарбоновых кислот. Синтезы грег-бутиловых эфиров аргинина, Незамещенного аргинина, гистидина и триптофана до настоящего времени не описаны. Этерификация серина и треонина с помощью изобутилена сопровождается алкилированием гидроксильных групп с образованием О-эфира [228]; правда, это не приводит к каким-либо осложнениям, поскольку простые грет-бутиловые эфиры расщепляются с такой же легкостью, как и соответствующие сложные эфиры. [32]
В белках семян растения большинство аминокислот находится в количестве 3 - 6 % общего содержания аминокислот в белках. Однако некоторые аминокислоты в белках могут и не быть, а метионин, цистин, триптофан и гистидин почти всегда имеются в белках в количестве менее 3 % общего содержания аминокислот. [33]
 |
Взаимосвязь белков, жиров и углеводов. [34] |
Получены доказательства синтеза глюкозы из большинства аминокислот. Для некоторых аминокислот ( аланин, аспарагиновая и глутами-новая кислоты) связь с глюконеогенезом является непосредственной, для других она осуществляется через побочные метаболические пути. Следует особо подчеркнуть, что три а-кетокислоты ( пируват, оксалоацетат и кето-глутарат), образующиеся соответственно из аланина, аспартата и глутамата, не только служат исходным материалом для синтеза глюкозы, но являются своеобразными кофакторами при распаде ацетильных остатков всех классов пищевых веществ в цикле Кребса для получения энергии. [35]
Амино - и карбоксильные группы большинства аминокислот, растворенных в жидкостях организма животных или растений ( а эти жидкости обычно имеют рН - 7), внутренне ионизированы так, что группы аммонийного и карбоксильного ионов образуются в одной и той же молекуле. [36]
ЦГГ), однако синтез большинства аминокислот кодируется более чем одним триплетом, в некоторых случаях даже до четырех, возможно варьирование трех нуклеотидов; так, и УАУ, и УАЦ кодируют синтез Генетическая информация передается при разделении двух витков спирали ДНК, затем происходит репликация за счет того, что на каждой старой цепи образуется новая цепь, при этом происходит связывание пар AT и ГЦ водородными связями. [37]
 |
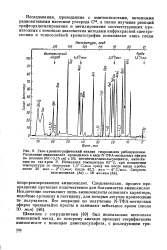
Спектр ЭПР.| Спектр ЭПР - облученной гуани-ловой кислоты.| Спектр ЭПР f - об. [38] |
Кроме того, в отличие от большинства аминокислот, в облученных белках и тканях интенсивность сигналов ЭПР быстро ( в течение часов и дней) падает вплоть до полного исчезновения сигнала. На этот процесс существенное влияние оказывают, как правило, кислород и влажность. [39]
Следовательно, процесс превращения протекает количественно для большинства аминокислот Исключение составляют лишь аминокислоты основного характера, подобные аргинину и гистидину, для которых летучие производные не получаются. [41]
Помимо общих путей обмена, характерных для большинства аминокислот, в настоящее время в животных тканях довольно подробно выяснены индивидуальные пути превращения почти всех аминокислот, входящих в состав белковых молекул. Некоторые из этих превращений в количественном отношении имеют второстепенное значение, но образующиеся из них продукты реакции могут играть важную, а иногда и решающую роль в процессах обмена веществ. Далее рассматривается выборочно обмен тех аминокислот, специфические ( так называемые частные) пути превращения которых в организме человека и животных определяют во многих отношениях его физиологическое состояние. [42]
Однако, по мнению авторов, содержание большинства аминокислот в органах и тканях на фоне такого питания не подвергается заметным изменениям. Нарушения устранялись, если животным вводили ретинол или витамин А. [43]
Особую роль трансаминирование играет в процессах дезаминирования большинства аминокислот, сопровождающихся превращением a - NH2 - rpynnbi в аммиак. [44]
 |
Реакция трансаминирования. Переносимая аминогруппа выделена красным. В большей части реакций трансаминирования акцептором аминогрупп служит а-кетоглутарат. [45] |
Страницы: 1 2 3 4