Большинство - катион
Cтраница 1
Большинство катионов образуют малорастворимые карбонаты. [1]
Большинство катионов с раствором аммиака образуют осадки гидроксидов или основных солей. Только катионы s - элементов ( кроме Mg2) не реагируют с раствором аммиака. [2]
Большинство катионов имеет склонность к образованию координационных соединений, в связи с чем высокая избирательность хелатообразования достигается довольно редко. В наибольшей степени это относится к мультидентатным хе-лантам, которые особенно прочно связывают катионы за счет эффекта хелатообразования. Тем не менее специальное построение молекул мультидентатных хелантов может привести к значительному повышению избирательности их реакций. [3]
Большинство катионов также не препятствует определению U ( IV), даже если присутствуют в 1000 - 10000-кратных весовых количествах. Цирконий и торий влияют достаточно сильно. [5]
Большинство катионов являются I-кислотами, а анионов - льюи-совскими основаниями. [6]
Большинство катионов третьей группы является энергичными комплексообразователями. [7]
Большинство катионов, в том числе V, Bi, Mo, в концентрации 5 мг / мл не влияют на поглощение 2 мкг / мл ртути. Мышьяк ( 3 - 5 мг / мл) снижает оптическую плотность на 4 - 7 %, Se, Те, Сг и Мп ( 0 1 - 0 2 мг / мл) существенно уменьшают величину оптической плотности. [8]
Большинство катионов являются L-кислотами, а анионов - льюи-совскими основаниями. [9]
Большинство катионов третьей группы является энергичными комплексообразователями. [10]
Большинство катионов третьей группы склонно к комплексообразова-нию. Они имеют характерные окраски: никеля - голубую, кобальта - розовую, цинка - бесцветную. Трехзаряд-ные катионы с органическими соединениями, содержащими гидроксильную группу ( глицерин, глюкоза и др.), и с оксикислотами ( содержащими, кроме карбоксильной группы СООН, гидроксильную группу ОН: винная, лимонная и др) образуют растворимые внутрикомплексные соединения настолько прочные, что они не разрушаются под влиянием реактивов, обычно осаждающих ионы этих металлов. [11]
Большинство катионов в кислой среде образуют очень неустойчивые комплексные соединения. [12]
Большинство катионов являются L - кислотами, а анионов - льюисовскими основаниями. Соли - типичные кислотно - основные комплексы. Как видно, электронная теория Льюиса рассматривает вопрос о кислотах и основаниях более широко, чем другие теории. [13]
Большинство катионов образуют комплексы с присутствующими анионами, а некоторые многоэарядные катионы образуют также и полимерные частицы. К сожалению, трудно установить, с какими частицами имеем дело, какие равновесия существуют в растворе, а также знать константы равновесий для этих и большинства других систем. [14]
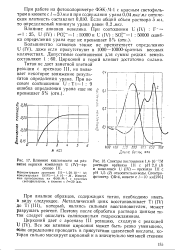 |
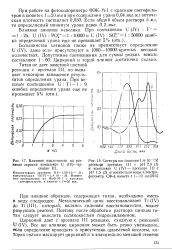
Влияние кислотности на раз - [ IMAGE ] Спектры поглощения 1 4 - 10 - аМ витие окраски комплекса U ( IV-ар - раствора арсеназо III с рН 2 0 ( 1. [15] |
Страницы: 1 2 3 4