Большинство - катион
Cтраница 3
Арсенаты большинства катионов малорастворимы в воде. Арсенаты щелочных металлов и аммония растворяются в воде. [31]
Сульфиды большинства катионов, так же как и окислы, нерастворимы в воде. Поскольку сероводород ( как и вода) - слабая кислота, растворимость сульфидов заметно меняется при изменении кислотности раствора. [32]
Взаимодействие большинства катионов с изучаемыми красителями происходит в определенном интервале рН, не изменяющемся при переходе от одного красителя к другому. [33]
Растворы большинства катионов 3 - й группы ( за исключением АГ и Zn) имеют характерную окраску. Ионы Fe окрашивают раствор в бледно-зеленый цвет, Fe - в тускло-желтый. Мп - в бледно-розовый, Сг - в сине-фиолетовый, или зеленый ( что зависит от различной его гидратации), Ni - в ярко-зеленый и Со - в розовый. [34]
Растворы большинства катионов 3 - й группы ( за исключением А1 1 и Zn) имеют характерную окраску. Ионы Fe окрашивают раствор в бледно-зеленый цвет, Fe - в тускло-желтый, Мп - в бледно-розовый, Сг - в сине-фиолетовый, Ni - в ярко-зеленый и Со - в розовый. [35]
Определению мешает большинство катионов, которые образуют с применяемым реактивом нерастворимые и окрашенные гидроокиси и иодиды. В таких случаях для удержания в растворе указанных ионов прибавляют тартрат калия ( или натрия) в качестве комплексообразо-вателя. [36]
С, большинство катионов занимают места I и II, что обеспечивает минимальное отталкивание между ними. В La-фожазите, дегидратированном при 475 С, большинство катионов занимают места I с координацией искаженного октаэдра [93], но небольшое их количество расположено также в местах Г и II. Такая конфигурация была бы крайне невыгодна электростатически, если бы между катионами не находился соединяющий их анион. Такие анионы могут занимать места 1Г или U, обеспечивая стабилизацию структуры. [37]
Капельному колориметрированию железа большинство катионов не мешает. [38]
В кислой моче большинство катионов щелочноземельных металлов удерживается в растворе в форме однозамещенных солей. [39]
Разработаны методики идентификации большинства катионов и анионов, встречающихся в неорганических системах. [40]
Допустимо присутствие следов большинства катионов и анионов, за исключением сильных окислителей. [41]
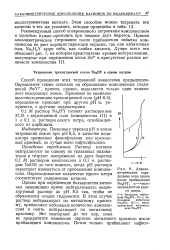 |
Алкалиметрическое определение иона цинка после прибавления Na3HY. a - число эквивалентов едкого натра. [42] |
Однако при определении большинства катионов невозможно прямо нейтрализовать анализируемый раствор до рН 8 5 так, чтобы не образовался осадок гидроокиси. В этом случае раствор нейтрализуют по метиловому красному, прибавляют небольшое количество комплексона и опять нейтрализуют по метиловому красному. Это повторяют до тех пор, пока не прекратится изменение окраски метилового красного после прибавления комплексона. [43]
Хотя комплексные соединения большинства катионов с комплексоном устойчивы в относительно кислых растворах и начинают заметно диссоциировать при рН около 3 - 4, до сих пор для титрования в кислой области рН не имеется в достаточном количестве пригодных комплексометрических индикаторов. В кислых растворах комплексы металлов с обычно применяемыми в аналитической химии индикаторами в значительной степени диссоциированы ил и вообще не образуются, поэтому установление конца титрования при помощи этих индикаторов совершенно невозможно. [44]
Однако в щелочных растворах большинство катионов осаждаются в виде гидроокисей или основных солей. [45]
Страницы: 1 2 3 4