Большинство - катион
Cтраница 2
Большинство катионов также не препятствует определению U ( IV), даже если присутствуют в 1000 - 10000-кратных весовых количествах. Цирконий и торий влияют достаточно сильно. [16]
Большинство катионов с хелатами образует внутрикомплексные соединения, хорошо растворимые в самом реагенте или других органических растворителях. [17]
Большинство катионов являются L-кислотами, а анионов - лью-исовскими основаниями. [18]
Большинство катионов образует с комплексоном более устойчивые комплексные соединения, чем магний. [19]
Большинство катионов переходных металлов образуют сильные связи с шестью молекулами диметилсульфоксида; при этом реакции обмена лигандов осуществляются гораздо труднее, чем, например, в ацетонитриле. Иодиды, бромиды и многие хлориды металлов класса ( а), например FeCl3 [127, 148] и VOC12 [80], в этом растворителе значительно ионизируются, поэтому образования соответствующих гало-генидных комплексных анионов не происходит. [20]
Большинство катионов двухвалентных металлов эффективнее элюи-руется из короткой катионообменной колонки только в. [21]
Для большинства катионов в системе комплексен - металл наблюдается образование водородных, нормальных и гидроксокомплексов. [22]
Для большинства катионов обмен молекул между координационной сферой катиона и остальным объемом раствора настолько быстрый, что наблюдается усредненный сигнал. [23]
Для большинства катионов III аналитической группы известны очень характерные капельные реакции, позволяющие открывать эти катионы дробным методом. Она основана на образовании гидроокисью алюминия труднорастворимого соединения ярко-красного цвета с органическим красителем ализарином. [24]
Растворы большинства катионов 3 - й группы ( за исключением А1 - и Zn) имеют характерную окраску. Ионы Fe окрашивают раствор в бледно-зеленый цвет, Fe - в тускло-желтый, Мп - в бледно-розовый, Сг - в сине-фиолетовый, Ni - в ярко-зеленый и Со - в розовый. [25]
Растворы большинства катионов 3 - й группы ( за исключением АГ и Zn) имеют характерную окраску. Ионы Fe окрашивают раствор в бледно-зеленый цвет, Fe - в тускло-желтый. Мп - в бледно-розовый, Сг - в сине-фиолетовый, или зеленый ( что зависит от различной его гидратации), Ni - в ярко-зеленый и Со - в розовый. [26]
Способность большинства катионов, присутствующих в никелевом электролите, давать анионные комплексы в хлоридных растворах с достаточной концентрацией ионов хлора позволяет применять процессы анионообменной экстракции, используя в качестве экстра-гентов соли аминов. Для никеля характерна наименьшая склонность к образованию комплексов, что дает возможность удалить большинство примесей из никелевого электролита при анионообменной экстракции. [27]
Титрование большинства катионов проводят при рН 5 б ( буферная смесь СН3СООН СНзСООМН4) или рН 8 - 10 ( буферная смесь NH4OH NH4C1), Однако нельзя слишком сильно повышать рН, так как в этом случае выпадает осадок гидроокиси металла. [28]
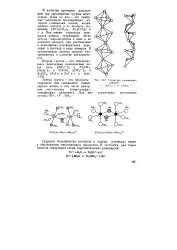 |
Структура полимерных анионов. [29] |
Гидролиз большинства катионов в водных растворах ведет к образованию многоядерных продуктов. [30]
Страницы: 1 2 3 4