Большинство - соль
Cтраница 1
Большинство солей кристаллизуется со значительным количеством молекул воды ( 4 - 8), а также образует двойные соли с соответствующими солями щелочных металлов или аммония. [1]
Большинство солей двух - п трехзарядных катионов разлагаются до т-ры их расплавления. В сильно щелочных растворах они восстанавливаются активными металлами ( цинком, алюминием) до аммиака, напр. [2]
Большинство солей, применяемых для нагрева деталей, содержит различные отравляющие вещества. Поэтому при их использовании необходимо строго соблюдать технику безопасности и все предписания по их применению. [3]
Большинство солей получается из водных растворов. Вследствие низкой растворимости тетрафторобо-ратов некоторые из них, например тетрафтороборат нитрона, применяются для весового определения тетрафтороборатов. При действии на свободный амин алкильных или арильных катионов тетрафтороборатов достигаются лучшие выходы замешенных солей. [4]
Большинство солей представляет собой твердые, кристаллические вещества. [5]
Большинство солей Сг3 растворимо в воде. Растворы их в зависимости от условий имеют различную окраску: на хелоде они обычно сине-фиолетового цвета, при нагревании - зеленого. Соли Сг3 и хромиты в растворе подвергаются гидролизу. [6]
Большинство солей Fe3 хорошо растворимо в воде. В водном растворе они сильно гидролизованы. В результате гидролиза образуются коллоидные растворы основных солей, имеющих желто-бурую окраску; сам ион Fe3 почти бесцветен. [7]
Большинство солей, образованных анионами других кислот, предпочтительно подвергается сольволизу. [8]
Большинство солей этой подгруппы катионов не растворимо в воде. Растворимы только азотнокислые и уксуснокислые соли. [9]
Большинство солей Sn2 1 бесцветно и хорошо растворимо в воде. Вследствие тенденции к переходу Sri2 в Sn4 1 производные двухвалентного олова ( а также - но в еще большей степени - германия) являются сильными восстановителями. Растворы их постепенно окисляются уже кислородом воздуха. [10]
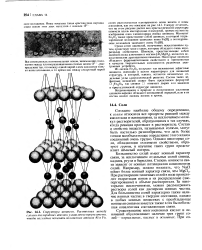 |
Структура шпинели. Расстояния между слоями кислородных атомов умышленно преувеличены, чтобы нагляднее показать положения атомов А1 и Fe. [11] |
Большинство солей имеет ионный характер связи, за исключением отдельных солей свинца, кадмия, ртути и бериллия. Степень ионности связи зависит от ионных потенциалов компонентов солей. При растворении типичных солей в воде происходит гидратация ионов и их распределение ( диспергирование) в объеме растворителя. [12]
Большинство солей этих кислот в воде малорастворимы, однако хорошо растворяются соли щелочных металлов и аммония. [13]
Большинство солей имеет вид твердых кристаллических веществ белого цвета, но соли меди голубого, кобальта - розового, никеля - зеленого цвета. Почти все соли соляной кислоты ( кроме AgCl, Hg2Cl2, РЬС12), а также азотной и уксусной кислот хорошо растворимы в воде. [14]
Большинство солей полностью ионизованы как в твердом состоянии, так и в растворах, а некоторые наиболее распространенные кислоты и основания, например НС1 и NaOH, почти полностью диссоциируют на ионы при растворении в воде. В таких случаях реакции, представленные уравнениями (15.1) и (15.2), по существу протекают до полного завершения, и к ним не следует применять законы равновесий. [15]
Страницы: 1 2 3 4