Большинство - фторид
Cтраница 2
Анализ малорастворимых объектов, содержащих мешающие компоненты ( удобрений, кормовых фосфатов, большинства фторидов), обычно состоит из двух стадий: 1) превращение фтора в растворимые соединения и их отделение от мешающих компонентов; 2) определение фтора в растворе. [16]
Среди большого числа необычных свойств фтористых соединений одним из наиболее замечательных является исключительно высокая летучесть большинства неионных фторидов. Из данных, приведенных в табл. 1, следует простое правило: из соединений типа M. FX наиболее летучими являются те, в которых атом М окружен наибольшим количеством атомов фтора. [17]
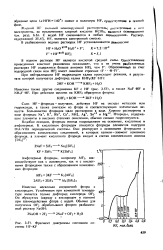 |
Фрагмент диаграммы состояния системы I1F - KF. [18] |
Соли HF - фториды - получают, действуя HF на оксиды металлов или гидроксиды, а также синтезом из фтора и соответствующих элементных веществ. Большинство фторидов мало растворимо в воде. Фториды, содержащие элементы в высоких степенях окисления, обычно сильно гидролизуются. [19]
 |
Фрагмент диаграммы состояния системы HF-KF. [20] |
Соли HF - фториды - получают, действуя HF на оксиды металлов или гидроксиды, а также синтезом из фтора и соответствующих элементных веществ. Большинство фторидов мало растворимо в воде. Фториды, содержащие элементы в высоких степенях окисления, обычно сильно гидролизу ются. [21]
Фториды всех одновалентных металлов образуют устойчивые кислые фторидные фазы. Это явление менее характерно для большинства фторидов двухвалентных металлов и совсем не характерно для большинства фторидов трехвалентных металлов. [22]
Методы синтеза фторидов азота разработаны достаточно детально почти для всех соединений этого класса. Способность фторидов азота к взаимным превращениям позволяет использовать эти реакции для синтеза большинства фторидов азота. [23]
Фториды всех одновалентных металлов образуют устойчивые кислые фторидные фазы. Это явление менее характерно для большинства фторидов двухвалентных металлов и совсем не характерно для большинства фторидов трехвалентных металлов. [24]
Вследствие низкой энергии диссоциации фтора теплоты образования соединений фтора в их стандартных состояниях таковы, что большинство фторидов сильно экзотермично; это прямо противоположно той ситуации, которая наблюдается для соединений азота, поскольку связь в N2 очень прочна. Далее, вследствие высокой электроотрицательности фтора в энергию связи значительный вклад вносит ионно-ковалентный резонанс. Кроме того, небольшие атомы, подобные F, могут образовывать более прочные связи вследствие большего перекрывания орбиталей и по этой причине гораздо более вероятно возникновение я-свяэей. Несомненно, образование фтором кратных связей является одним из возможных факторов, приводящих к укорочению многих связей - например, в BF3 и SiF4 - по сравнению со связями, образованными другими галогенами. [25]
Вследствие низкой энергии диссоциации фтора теплоты образования соединений фтора в их стандартных состояниях таковы, что большинство фторидов сильно экзотермично; это прямо противоположно той ситуации, которая наблюдается для соединений азота, поскольку связь в N. Далее, вследствие высокой электроотрицательности фтора в энергию связи значительный вклад вносит ионно-ковалентный резонанс. Кроме того, небольшие атомы, подобные F, могут образовывать более прочные связи вследствие большего перекрывания орбиталей и по этой причине гораздо более вероятно возникновение я-связей. Несомненно, образование фтором кратных связей является одним из возможных факторов, приводящих к укорочению многих связей - например, в BF3 и SiF4 - по сравнению со связями, образованными другими галогенами. [26]
Из галогенов наиболее активным, как известно, является фгор. Однако с металлами реакции фторирования идут с небольшой скоростью. Это объясняется тем, что большинство фторидов металлов имеет сравнительно высокую температуру испарения, и на поверхности металлов образуются плотные защитные пленки фторидов, которые препятствуют дальнейшему действию фтора на основную массу металла. При получении нелетучих фторидов реакцию проводят в течение длительного времени, а исходные металлы или неметаллы применяют в виде порошка, тем самым увеличивая реагирующую поверхность. Вообще же безводные фториды металлов редко получают фторпропаинем их, так как имеютгя тфугне. [27]
Из галогенов наиболее активным, как известно, является фтор. Однако с металлами реакции фторирования идут с небольшой скоростью. Это объясняется тем, что большинство фторидов металлов имеет сравнительно высокую температуру испарения, и на поверхности металлов образуются плотные защитные пленки фторидов, которые препятствуют дальнейшему действию фтора на основную массу металла. При получении нелетучих фторидов реакцию проводят в течение длительного времени, а исходные металлы или неметаллы применяют в виде порошка, тем самым увеличивая реагирующую поверхность. Вообще же безводные фториды металлов редко получают фторированием их, так как имеются другие, более простые и быстрые способы, например действие фтора на хлориды или высушивание кристаллогидратов фторидов в токе фтористого водорода. [28]
В ряде работ было показано, что тетрафторид кремния, независимо от метода его получения, отличается химической устойчивостью и инертностью ро отношению к окислителям и восстановителям. Кислый характер SiF4 подтверждается также поглощением его различными окислами основного характера. Вполне соответствует этому и его взаимодействие с большинством фторидов, в результате которого образуются фторосиликаты. С безводным фтористым водородом тетрафторид кремния не реагирует [64, 228], так как фторид удерживается более прочно протоном. [29]
Галогеноводороды НГ в водном рпстворе являются кислотами. Фтористоводородная кислота Н1: - кислота средней силы, остальные - сильные кислоты. Большинство солей HCI, НВг и HI хорошо растворимы в воде. Большинство фторидов малорастворимо в воде. [30]
Страницы: 1 2 3