Подавляющее большинство - молекула
Cтраница 1
Подавляющее большинство молекул имеют значения скорости г., близкие к наиболее вероятной VH, соответствующей максимуму этого распределения при данной температуре. Однако существует некоторая часть молекул с меньшими и большими скоростями. [1]
Поэтому подавляющее большинство молекул не может преодолеть этих сил, и только молекулы, обладающие в данный момент энергией, значительно большей, чем средняя для данной температуры ( см. § 34), будут в состоянии вылететь из жидкости. Такие молекулы всегда составляют лишь малую долю общего числа молекул. Иначе жидкость испарялась бы практически мгновенно и вещество находилось бы в данных условиях не в жидком, а в газообразном состоянии. [2]
 |
Схема испарения жидкости. а-в открытом сосуде. б-в закрытом сосуде. [3] |
Поэтому подавляющее большинство молекул не может преодолеть этих сил, и только молекулы, обладающие в данный момент энергией, значительно большей, чем средняя для данной температуры ( см. § 34) будут в состоянии вылететь из жидкости. Такие молекулы всегда составляют лишь малую долю общего числа молекул. Иначе жидкость испарялась бы практически мгновенно и вещество находилось бы в данных условиях не в жидком, а в газообразном состоянии. [4]
В подавляющем большинстве молекул органических соединений основной электронный уровень не вырожден. [5]
Однако для подавляющего большинства молекул число потенциальных постоянных [ S / / ( / - - 1) здесь сумма берется по всем, типам симметрии; см. стр. Одним из способов преодоления этой трудности является исследование изотопических молекул. Другой способ заключается в уменьшении числа искомых силовых постоянных с помощью некоторых более специальных предположений о характере силового поля молекулы. [6]
Из таблицы видно, что подавляющее большинство молекул имеет скорость в пределах от 200 до 600 м / сек. Больше всего молекул приходится на интервал скоростей от 300 до 400 м / сек. [7]
Следует отметить, что химические связи в подавляющем большинстве молекул носят в значительной степени промежуточный ( между двумя рассмотренными случаями) характер. Поэтому для описания характера химической связи весьма удобно использовать понятие степени ценности связи. Под степенью ионности связи подразумевают следующее: насколько интенсивно валентные электроны одного из взаимодействующих атомов оттягиваются к другому при образовании молекулы. В гомонуклеарных молекулах, в которых связь предельно ко-валентна, степень ионности равна нулю. Степень ионности связи возрастает с увеличением различий в химической природе взаимодействующих атомов и достигает максимального значения в молекулах галогенидов щелочных металлов. [8]
Однако при больших d, когда прослойки окислителя велики, подавляющее большинство молекул окислителя сначала разлагается, и затем кислород диффундирует к поверхности частиц горючего. [9]
Согласно закону распределения молекул по скоростям, в массе реагирующих веществ подавляющее большинство молекул обладают некоторой средней для данной температуры скоростью и средним запасом энергии. [10]
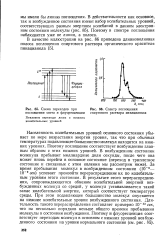 |
Схема переходов при поглощении света и флуоресценции.| Спектр поглощения спиртового раствора пинацианола. [11] |
Населенность колебательных уровней основного состояния убывает по мере возрастания энергии уровня, так что при обычных температурах подавляющее большинство молекул находится на нижних уровнях. Поэтому поглощение соответствует возбуждению главным образом с этих нижних уровней. За время пребывания молекул в возбужденном состоянии ( 10 - 8 - 10 - 9 сек) успевает произойти перераспределение их по колебательным уровням этого состояния. В результате этого перераспределения, сопровождающегося обменом колебательной энергией возбужденных молекул со средой, у молекул устанавливается такой запас колебательной энергии, который соответствует температуре среды. При этом подавляющее большинство молекул опускается на нижние колебательные уровни возбужденного состояния. Длительность такого перераспределения составляет примерно 10 - 13 сек, что на несколько порядков меньше общего времени пребывания молекулы в состоянии возбуждения. [12]
Кристаллы, содержащие огромное количество атомов ( - 1023), на первый взгляд кажутся намного сложнее подавляющего большинства молекул - систем из сравнительно небольшого числа атомов. [13]
После этого, сколько бы щелочи ни добавляли, окраска больше изменяться не будет, так как изменение окраски вызывается уменьшением количества недиссоциированных молекул и увеличением количества ионов, а при рН р / Синд 1 уже подавляющее большинство молекул Hind диссоциировано и число их в растворе больше увеличиваться не может. [14]
 |
Интервалы перехода некоторых индикаторов. [15] |
Страницы: 1 2 3