Подавляющее большинство - реакция
Cтраница 3
Для подавляющего большинства реакций температурный коэффициент скорости реакции больше 1, причем величина его может изменяться в широких пределах. [31]
Для подавляющего большинства реакций трансмиссионный коэффициент равен единице; это означает, что каждый активированный комплекс превращается в продукт реакции. Однако существуют два класса реакций, для которых этот коэффициент может быть значительно меньше единицы. К первому классу относятся бимолекулярные реакции рекомбинации атомов в газовой фазе и обратимые реакции распада двухатомных молекул. [32]
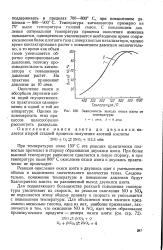 |
Зависимость выхода окиси азота от температуры. [33] |
Для подавляющего большинства реакций повышение температуры увеличивает их скорость, но реакция окисления NO в NOa не подчиняется этому общему правилу и скорость ее уменьшается с повышением температуры. Для объяснения этого явления предложено несколько гипотез, одна из них, наиболее признанная, заключается в том, что окисление NO в NO2 идет через образование промежуточного продукта - димера окиси азота: ( см. стр. [34]
Скорость подавляющего большинства реакций зависит от температуры; для простых и почти - для всех сложных реакций скорость повышается с ростом температуры. [35]
Для подавляющего большинства реакций характерно увеличение скорости с повышением температуры, но реакция окисления NO в NO2 не подчиняется этому общему правилу и скорость ее уменьшается с повышением температуры. Таких реакций немного и их называют аномальными. Окисление NO в NO2 является наиболее медленной стадией процесса получения азотной кислоты. Поэтому для установок, работающих под атмосферным давлением, требуются большие по объему окислительно-абсорбционные башни. [36]
Для подавляющего большинства реакций характерно увеличение скорости с повышением температуры, но реакция окисления NO в МО2 - не подчиняется этому общему правилу и скорость ее уменьшается с повышением температуры. Таких реакций немного и их называют аномальными. Окисление NO в NO2 является наиболее медленной стадией процесса получения азотной кислоты. Поэтому для установок, работающих под атмосферным давлением, требуются большие по объему окислительно-абсорбционные башни. [37]
Скорость подавляющего большинства реакций зависит от температуры; для простых реакций и почти для всех сложных скорость реакции повышается с ростом температуры. [38]
Для подавляющего большинства реакций горения до сих пор не имеется, к сожалению, надежных кинетических схем, особенно при высоких температурах. [39]
В подавляющем большинстве реакций, происходящих в твердых телах, сама химическая реакция на межфазовой границе протекает достаточно быстро, и скорость суммарного процесса определяется процессами переноса и диффузии. Приведенные взгляды разных ученых на механизм коррозии силикатных стекол ни в коей мере не противоречат и не исключают друг друга. Они лишь описывают этот процесс с разных позиций: физико-химической, чисто химической и физической. [40]
В подавляющем большинстве реакций фосфорилирования, проводившихся в области нуклеотидов, углеводов и фосфолипидов, использованы четыре отмеченных класса реагентов, а именно: аренсульфонилхлориды, карбодиимиды, фосфохлориды или тетра-эфиры пирофосфатов и амидофосфаты. Однако на протяжении последних десятилетий значительные усилия были затрачены на разработку других простых избирательных фосфсрилирующих агентов, для реакции которых требуется минимальная или не требуется вовсе защита обрабатываемого субстрата. [41]
Рассчитать скорости подавляющего большинства реакций в настоящее время не представляется возможным. Для проектирования промышленных реакторов необходимы экспериментальные кинетические исследования. [42]
Поскольку для подавляющего большинства реакций гидратации и дегидратации, имеющих синтетическое значение ( гидратация олефинов и ацетиленовых соединений, гидролиз галоген - и азотсодержащих соединений, гидролиз эфиров и углеводов, дегидратация спиртов, конденсация альдегидов и кетонов), существенных различий между жидкими и твердыми кислотно-основными катализаторами не наблюдается, можно, вероятно сказать, что гипотеза Рогинского и Иоффе в основном отражает действительность. [43]
Однако в подавляющем большинстве реакций образование изомерных пиразоле-нинов не подчиняется правилу Ауверса. [44]
Второму условию подчиняется подавляющее большинство реакций между устойчивыми молекулами. [45]
Страницы: 1 2 3 4