Переход - комплекс
Cтраница 1
Переход комплекса из основного состояния с энергией Wfj в возбужденное состояние с энергией WE и обусловливает появление дополнительной полосы в спектре поглощения комплекса. [1]
Переход комплексов арсенида и теллурида кадмия из раствора в твердую фазу происходит с положительным балансом, причем для арсенида индия он больше, чем для теллурида кадмия. При переходе в твердую фазу комплекса арсенида индия выделяется энергия связи ( СтпАз) и энергия изменения энтальпии смешения, равная ( Ui. Аналогично для теллурида кадмия Ссате и ( Ь - & rs) cdTe - Но энергия смешения в твердой фазе для арсенида индия заметно меньше, чем для теллурида кадмия, так как вероятность оказаться окруженным одинаковыми элементами для арсенида индия много больше, чем для теллурида кадмия. [2]
Критерием перехода комплекса в продукты реакции является прохождение его через критическую конфигурацию - переходное состояние. Если он переходят через него, образуются продукты. [3]
Критерием перехода комплекса в продукты реакции является прохождение его через критическую конфигурацию - переходное состояние. Если он переходят через него, образуются продукты. Движение однажды образованного активированного комплекса вдоль координаты реакции характеризуется растяжением некоторых соответствующих связей: поэтому прохождение активированного комплекса через переходное состояние может быть идентифицировано с особой колебательной модой. [4]
Однако времени на переход сернокисло-молибденового комплекса и молибденовой кислоты в молибдаты достаточно для того, чтобы из верхней части месторождений молибден мог быть выщелочен. Такое выщелачивание особенно отчетливо проявляется в кварц-молибденовых месторождениях, расположенных в некарбонатной среде, в районах сухого и жаркого пустынного климата, с длительным существованием континентального режима при устойчивом рельефе участков месторождений. При этом молибденит вначале переходит в повеллит, далее в ферримолебдит, затем в молибденсодержащий лимонит, и, наконец, в лимонит. Степень окисления молибденита снижается по мере увеличения глубины залегания рудных жил. [5]
Нагревание может вызвать 1) переход комплекса из метастабильнои модификации в стабильную; 2) переход комплекса в высокотемпературную модификацию, если такая имеется. [6]
Разделение редкоземельных элементов определяется степенью перехода катиониых комплексов в электронейтральные и анионные. Описана регенерация ЭДТА путем подкисления ее растворов. [7]
При флотации с двумя рабочими жидкостями переход комплексов частица-пузырек, а точнее частица-пузырек труднорастворимого газа - пузырек легкорастворимого газа из жидкости в пену осуществляется в 2 - 2 5 раза быстрее, чем при обычной флотации. Уплотнение пенного слоя также идет более интенсивно. Как показывают проведенные нами экспериментальные исследования, структура образующейся пены имеет крупноячеистые элементы. Концентрация микробной биомассы в пене вследствие уменьшения ее объема увеличивается в 2 - 3 раза. Созданию более компактного пенного слоя, по-видимому, способствует выход из жидкой фазы большего количества легкорастворимого газа. Дополнительные сведения могут быть получены при изучении влияния реагентов на уплотнения пенного слоя. [8]
Если не равно, то осуществляется переход комплекса мероприятий MI с / - и оси затрат на к-ю ось затрат - Mi - MK l - x K при фиксированных узловых точках / и к, не соответствующих друг другу. [9]
Даже весьма большой избыток меди не вызывает перехода прочного фиолетового железо-салицилатного комплекса в менее прочный ( с большей константой диссоциации) желтый салицилат-ный комплекс меди. Отсюда следует, что максимально допустимая кислотность при фотометрическом определении железа ( посредством салицилата) может быть значительно большей, чем при определении меди. [10]
Даже весьма большой избыток меди не вызывает перехода прочного фиолетового железо-салицилатного комплекса в менее прочный ( с большей константой диссоциации) желтый салици-латный комплекс меди. Отсюда следует, что максимально допустимая кислотность при колориметрическом определении железа ( посредством салицилата) может быть значительно большей, чем при определении меди. Этот вывод полностью подтверждается опытом. [11]
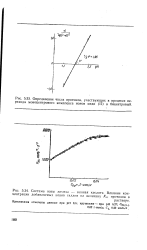 |
Система ионы железа - винная кислота. Влияние концентрации добавляемых ионов галлия на величину Ля. протонов в. [12] |
Определение числа протонов, участвующих в процессе перехода моноцентрового комплекса ионов меди ( II) в бицентровый. [13]
Образование гидратов, видимо, также препятствует переходу комплекса ниобия в органическую фазу. [14]
Для ряда практических задач считают К 0, так как вероятность перехода комплекса частица - пузырек в суспензию достаточно мала. Более вероятен переход частиц из пенного слоя в суспензию, характеризуемый константой К5, на которую в определенной мере влияет константа К, характеризующая физико-химические свойства пенного слоя. [15]
Страницы: 1 2 3 4