Переход - растворитель
Cтраница 2
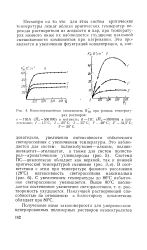 |
Концентрационная зависимость Rc Q при разных температурах растворов. [16] |
Несмотря на то что для этих систем критические температуры лежат вблизи критических температур перехода растворителя из жидкости в пар, при температурах намного ниже их наблюдается ухудшение взаимной смешиваемости компонентов при нагревании. [17]
Осмотическое давление - избыточное давление, которое необходимо приложить к раствору, чтобы предотвратить переход растворителя через полупроницаемую мембрану. [18]
Осмотический метод заключается в следующем: по величине гидростатического давления, при котором прекращается переход растворителя в раствор ( гл. [19]
Осмотическое давление - избыточное давление, которое необходимо приложить к раствору, чтобы предотвратить переход растворителя через полупроницаемую мембрану. [20]
Осмотический метод заключается в следующем: по величине гидростатического давления, при котором прекращается переход растворителя в раствор ( гл. [21]
Установлено, что осмотическое давление проявляется в том случае, когда обе жидкости минерализованы, причем наблюдается переход растворителя из раствора меньшей концентрации солей. [22]
Согласно формуле (81.5) имеем: ( зц - si) T q, где q - теплота перехода растворителя из первой фазы во вторую. [23]
Давление осмотическое ( 94, 95) - избыточное давление я, которое необходимо приложить к раствору, чтобы предотвратить переход растворителя через полупроницаемую мембрану. [24]
Согласно формуле ( 81 5) имеем: ( sn - s1) 71 7, где q - теплота перехода растворителя из первой фазы во вторую. [25]
Во-вторых, уменьшению давления пара над раствором способствует процесс сольватации ( гидратации), приводящий к образованию более или менее прочных сольватов ( гидратов), из которых переход растворителя в пар будет более затруднен. [26]
Во-вторых, уменьшению давления пара над раствором способствует процесс сольватации ( гидратации), приводящий к образованию более или менее прочных сольватов ( гидратов), из которых переход растворителя в пар будет затруднен. [27]
 |
Нахождение нулевой рис ш Нмождение эталонной точки. [28] |
Через каждые / з часа путем взвешивания определяют скорость перехода растворителя в одну или другую сторону от мембраны ( рис. 131) - Из полученных данных графически вычисляют давление, при котором скорость перехода растворителя равна нулю. [29]
Предполагаемая зависимость объемного эффекта активации от сжимаемости растворителя, о которой писал Брауэр, аналогична закономерности, отмеченной, по-видимому, впервые в работе Хаманна и Лима [41 ] при сопоставлении сжимаемости растворителей с уменьшением объема при внесении в них ионов: чем больше сжимаемость растворителя, тем больше возможности для сжатия при переходе растворителя из объема раствора в сольватную оболочку иона. Казалось бы, что те же причины должны приводить и к уменьшению объемного эффекта активации ( точнее, его сольватационной составляющей) по мере уменьшения сжимаемости растворителя. Ниже в табл. 61 приведены данные о реакции пиридина с йодистым этилом в различных растворителях. Из этих результатов следует, что в общем имеется некоторая ( хотя и не очень четкая) тенденция к увеличению объемного эффекта активации при переходе к растворителям, обладающим большей сжимаемостью. [30]
Страницы: 1 2 3 4