Переход - реакция
Cтраница 1
Переход реакции из одной области в другую связан с рядом признаков, наиболее характерным из которых является температурная зависимость скорости реакции. [1]
Переход реакции из стадии I в стадию II происходит при температурах 1373 и 1473 К в течение ограниченного промежутка времени, а при 1273 К этот переход непрерывен. Если матрица в исходном состоянии насыщена углеродом, то углерод уже не может растворяться в матрице и зона взаимодействия растет быстрее. [2]
Переход реакции из одной области в другую связан с рядом признаков, наиболее характерным из которых является температурная зависимость скорости реакции. [3]
Переход реакций в диффузионную область при повышении давления может быть проиллюстрирован еще одним примером. [4]
Переход реакции распада МОС, с поверхности в объем паровой фазы облегчается увеличением концентрации МОС в паровой фазе и повышением температуры паровой фазы до температур, близких к температурам распада МОС. Это доказывает, что распад в объеме так же, как и распад на поверхности с образованием пленки, является по существу гетерогенным, хотя бы уже на стадиях роста зерен порошка. Стадия зародышеобразования может быть гомогенной. Особенностью распада в объеме является то, что время нахождения паровой фазы в зоне разложения определяет величину зерен порошка таким образом, что чем боль-иге время, тем. [5]
Скорость перехода реакции от периода индукции до экспоненциального нарастания зависит от коэффициента разветвления цепи. [6]
При переходе реакции А2 - - А3 во внешнедиффузионную область ( к2 р2) целевой продукт вовсе не образуется. [7]
При переходе реакции во внешнедиффузионный режим концентрация ключевого компонента становится малой величиной по сравнению с концентрацией остальных компонентов, и наблюдаемая скорость будет зависеть лишь от концентрации этого компонента. [8]
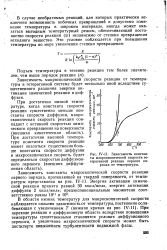 |
Зависимость константы макроскопической скорости гетерогенной реакции первого порядка от температуры. [9] |
При переходе реакции в диффузионную область вследствие повышения температуры существенными становятся условия диффузионного переноса, и увеличение макроскопической скорости может быть достигнуто повышением турбулентности подвижной фазы. [10]
Точка излома соответствует переходу реакции в область, где она определяется скоростью растворения газа в жидкости. Постоянная скорость реакции, соответствующая прямолинейному участку, очевидно, соответствует этой скорости. [12]
При каталитическом окислении изооктана переход реакции в диффузионную область происходит скачкообразно; реакция в диффузионной области протекает с интенсивным тепловыделением и при 700 - 800 характеризуется большими абсолютными скоростями. Скорость диффузии к поверхности катализатора для углеводородов с близкими значениями молекулярных весов должна быть практически одинаковой и слабо возрастать с температурой. В табл. 42 приведены значения энергий активации Е и предэкспоненциальных множителей К0 для исследованных углеводородов. [13]
Необходимо подчеркнуть, что такой переход реакции от необратимой к обратимой является следствием того механизма, который мы приняли для нее в области кислых растворов. В более щелочных растворах ход поляризационной кривой определяется уже закономерностями концентрационной поляризации. В частности, при увеличении рН раствора потенциал восстановления должен меняться по такой же зависимости, как и потенциал равновесного окислительно-восстановительного электрода системы кислород - перекись водорода. [14]
Эти давления и определяют пределы перехода реакции во взрыв. Следовательно, условие пределов самовоспламенения эквивалентно условию т оо. [15]
Страницы: 1 2 3 4
