Период - полуобмен
Cтраница 2
Из данных рис. 1 графически определены периоды полуобмена для трех изученных концентраций комплексного иона. [16]
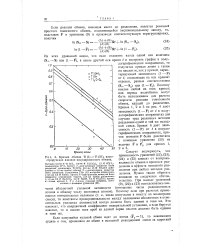 |
Кривые обмена Т1 ( I - Т1 ( III, иллюстрирую дне влияние индуцированного обмена. [17] |
Поэтому наклон любой из этих кривых или период полуобмена могут быть использованы для расчета скорости реакции гомогенного обмена, идущей до разделения. Кривые 1, 2 и 3 на рис. 4 дают зависимость ( 1 - F) от t в полулогарифмических координатах для случаев трех различных методов разделения одной и той же исходной смеси. [18]
На этом же рисунке показан метод определения периода полуобмена. Если процесс изотопного обмена протекает двумя параллельными путями, то на графике зависимости In ( 1 - F) от t будет наблюдаться излом. [19]
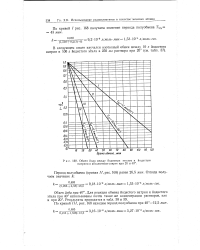 |
Обмен йода между йодистым этилом и йодистым натрием в абсолютном спирте при 20 и 40. [20] |
По кривой / рис. 168 получаем значение периода полуобмена Ti / a 43 мин. [21]
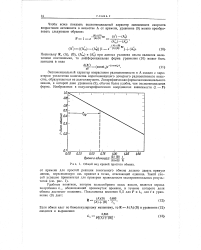 |
Общий вид кривой простого обмена. [22] |
Удобным понятием, которое целесообразно здесь ввести, является период полуобмена Л, , обозначающий промежуток времени, в течение которого доля обмена достигает половины. [23]
По кривой / / /, рис. 168 находим период полуобмена при 40 - 12 5 мин. [24]
Время, за которое обмен проходит наполовину, называют периодом полуобмена / а. Если концентрации а и b известны, а х и х определены экспериментально, то можно найти R. Расчет особенно упрощается, если зависимость [ 1 - xlx ] от t изо-бразить на полулогарифмической бумаге. По полученной прямой графически можно найти период полуобмена. [25]
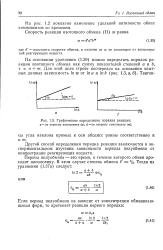 |
Графическое определение порядка реакции. а - по первому компоненту ( п. б - по второму компоненту ( т. [26] |
Другой способ определения порядка реакции заключается в экспериментальном изучении зависимости периода полуобмена от концентрации реагирующих веществ. [27]
Поэтому наклон любой из этих кривых или найденный с их помощью период полуобмена могут быть использованы для расчета скорости реакции гомогенного обмена, протекавшей в системе до разделения обменивающихся форм. [28]
Гельферих [20] предложил для этой цели полуэмпирический критерий, равный отношению периодов полуобмена чисто внутри-диффузионного и чисто внешнедиффузионного процессов. При этом сами периоды полуобмена он рассчитывает, соответственно, по уравнению диффузии с постоянным коэффициентом диффузии, равным среднему геометрическому коэффициентов самодиффузии обоих ионов, и по упрощенному варианту уравнения Адамсона и Гроссмана [ уравнение ( XI. Обе процедуры могут рассматриваться лишь как грубое приближение и в общем случае сомнительны. Трудность применения такого критерия Гельфериха состоит в невозможности даже приближенного указания практических границ области процесса со смешаннодиффузионным механизмом. Утверждение Гельфериха, что вклад обоих процессов в кинетику одинаков, если рассматриваемое отношение полупериодов близко к 1, также не следует понимать буквально, так как оно не основано на точном анализе. Нетрудно убедиться, что для изотопного обмена, например, в этом случае Bi 7 5, что соответствует существенному преобладанию роли внутридиффузионного процесса. [29]
Комплексы Сг11 и Со 1 подвергаются обмену лигандами при 25 с периодами полуобмена ( Ti / 2) порядка нескольких часов, суток и даже недель, что, следовательно, делает их подходящими системами для подробных кинетических исследований и изучения механизма реакций. Некоторые факторы, ответственные за большие интервалы скоростей реакции, будут рассмотрены в дальнейшем ( разд. [30]
Страницы: 1 2 3 4