Период - элемент
Cтраница 1
Период элементов характеризует общую структуру атома, а группа - структуру его внешних оболочек. Это как бы координаты в таблице Менделеева. Их пересечению отвечает только один элемент со строго индивидуальными его свойствами. [1]
Периоды элементов носят таким образом иной характер, чем привычные периоды, геометрами столь просто выражаемые. [2]
Начало периода элементов совпадает с началом образования нового электронного слоя. Каждый период завершается благородным газом. [3]
Менделеев расположил периоды элементов ( см. табл. 8) друг под другом и в результате составил периодическую систему элементов. [4]
Менделеев расположил периоды элементов ( см. табл. 4) друг под другом и в результате составил периодическую систему элементов. [5]
Заполнение слоев электронами соответствует периодам элементов в таблице Менделеева. Действительно, количество элементов в периодах совпадает с указанными числами, но в другой последовательности: 2, 8, 8, 18, 18, 32, а VII период не завершен. [6]
Поскольку в задаче предлагается рассмотреть первые четыре периода элементов, обсуждения геометрии / - орбиталей не требуется. [7]
Правило Клечковского позволяет сделать прогноз о строении восьмого периода элементов ( В, И. [8]
Он заметил, что разность атомных весов соседних по периоду элементов может быть большой и незначительной. [9]
Обобщая, можно сказать, что с позиций квантовой механики период элементов в таблице Менделеева - понятие энергетическое, что схематически ( без соблюдения масштабов) представлено на рисунке III-9. Рисунок иллюстрирует рост энергетического состояния электронов от периода к периоду. [10]
Насыщение восемью электронами ( электронным октетом) 2-го слоя соответствует образованию последнего в периоде элемента - пассивного в химическом отношении инертного газа неона. [11]
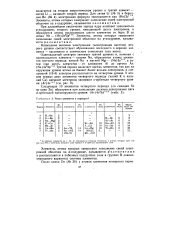 |
Число элементов в периодах. [12] |
Насыщение восемью электронами ( электронным октетом) второго уровня соответствует образованию последнего в периоде элемента - пассивного в химическом отношении газа неона. [13]
При расположении всех элементов по величине их атомного веса замечается повторение свойств в периодах элементов и в то же время - усложнение периодов. [14]
По степени возрастания атомной массы за неоном следует щелочной металл натрий Na, которым и начинается третий период элементов. Здесь, как и во втором периоде, наблюдается ослабление металлических и усиление неметаллических свойств. Через типичный галоген хлор С1 период заканчивается инертным элементом - аргоном Аг. С калия начинается четвертый ( большой) период, состоящий из двух рядов - верхнего и нижнего. [15]
Страницы: 1 2 3