Внутренняя периодичность
Cтраница 3
Как у лантанидов, так предположительно и у актинидов наблюдается своеобразная внутренняя периодичность: при движении по периоду валентности сначала возрастают, а затем снижаются, и повторяется это дважды, тоесть периодически. В результате наблюдается своего рода закон октав: каждый восьмой из них ( по порядку возрастания номеров) повторяет свойства первого. [31]
Актиниды, так же как и лантаниды, правильнее всего в соответствии с четко выраженной внутренней периодичностью их строения и свойств считать побочным рядом седьмого периода и выносить в две строки, располагая их по соответствующим группам. III группы, и заканчиваются также элементами III группы - галлием, индием, таллием и лютецием. [32]
Периодический характер заполнения 4 / орбиталей сначала по одному, а затем по два электрона предопределяет внутреннюю периодичность в изменении свойств лантаноидов и их соединений. [33]
Периодический характер заполнения 4 / - орбиталей сначала по одному, а затем по два электрона предопределяет внутреннюю периодичность в изменении некоторых свойств лантаноидов, например, степеней окисления. Элементы, примыкающие к лантану ( 4 /), гадолинию ( 4 / 7) и лютецию ( 4 / 14), имеют переменные состояния окисления. [34]
Периодический характер заполнения 4 / - орбиталей сначала по одному, а затем по два электрона предопределяет внутреннюю периодичность в изменении свойств лантаноидов и соединений. [35]
В ряду соединений Cl ( VII) - Br ( VII) - I ( VII) отчетливо проявляется внутренняя периодичность. В отличие от С1 и I степень окисления 7 для Вг не характерна. [36]
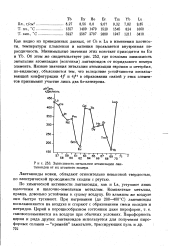 |
Зависимость энтальпии атомизации лантаноидов от их атомного номера. [37] |
Как видно из приведенных данных, от Се к Lu в изменении плотности, температуры плавления и кипения проявляется внутренняя периодичность. Минимальные значения этих констант приходятся на Ей и Yb. Об этом же свидетельствует рис. 253, где показана зависимость энтальпии атомизации ( возгонки) лантаноидов от порядкового номера элемента. Низкие значения энтальпии атомизации европия и иттербия, по-видимому, объясняются тем, что вследствие устойчивости несвязывающей конфигурации 4 / и 4 / 4 в образовании связей у этих элементов принимают участие лишь два б - электрона. [38]
В ряду соединений Cl ( VII) - Вг ( VII) - I ( VII) отчетливо проявляется внутренняя периодичность ( см. с. В отличие от С1 и I степень окисления 7 для Вг не характерна. [39]
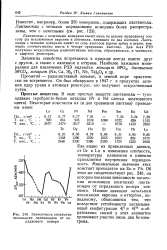 |
Зависимость энтальпии атомизации лантаноидов от порядкового номера. [40] |
Как видно из приведенных данных, от Се к Lu в изменении плотности, температуры плавления и кипения проявляется внутренняя периодичность. Минимальные значения этих констант приходятся на Ей и Yb. Об этом же свидетельствует рис. 248, на котором показана зависимость энтальпии атомизации ( возгонки) лантаноидов от порядкового номера элемента. Низкие значения энтальпии атомизации европия и иттербия, по-видимому, объясняются тем, что вследствие устойчивости несвязывающей конфигурации 4 / 7 и 4 / 14 в образовании связей у этих элементов принимают участие лишь два Gs-элек-трона. [41]
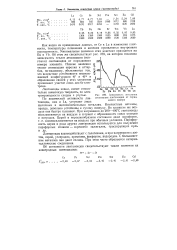 |
Зависимость энтальпии атомизации лантаноидов от порядкового номера. [42] |
Как видно из приведенных данных, от Се к Lu в изменении плотности, температуры плавления и кипения проявляется внутренняя периодичность. Минимальные значения этих констант приходятся на Ей и Yb. Об этом же свидетельствует рис. 239, на котором показана зависимость теплот атомизации ( возгонки) лантаноидов от порядкового номера элемента. Низкие значения теплот атомизации европия и иттербия, по-видимому, объясняются тем, что вследствие устойчивости несвязывающей конфигурации 4 / 7 и 4 / 14 в образовании связей у этих элементов принимают участие лишь два Gs-элек-трона. [43]
Как видно из приведенных данных, от Се к Lu в изменении плотности, температуры плавления и кипения проявляется внутренняя периодичность. Минимальные значения этих констант приходятся на Ей и Yb. Об этом же свидетельствует рис. 248, на котором показана зависимость энтальпии атомизации ( возгонки) лантаноидов от порядкового номера элемента. Низкие значения энтальпии атомизации европия и иттербия, по-видимому, объясняются тем, что вследствие устойчивости несвязывающей конфигурации 4 / 7 и 4f14 в образовании связей у этих элементов принимают участие лишь два бх-элек-трона. [44]
Как видно из приведенных данных, при переходе от Се к Lu в изменении плотности, температуры плавления и кипения проявляется внутренняя периодичность. Лантаноиды ковки, имеют относительно невысокую твердость, по электропроводности сходны с ртутью. [45]
Страницы: 1 2 3 4