Внутренняя периодичность
Cтраница 2
В химии редкоземельных элементов наиболее ярко проявляется внутренняя периодичность, особенно для производных в характеристической степени окисления. Объяснение этому факту было дано в § 5 гл. Для иллюстрации внутренней периодичности в табл. 25 приведены цвет гидратированных ионов Э3, стандартные энергии Гиббса образования трифторидов и проявляемые степени окисления. Наблюдается удивительная аналогия в свойствах элементов, находящихся друг под другом. В каждой семерке, составляющей внутренний период, ионизационные потенциалы третьего порядка монотонно растут ( см. табл. 24) с уменьшением атомных радиусов вследствие лантаноидной контракции. Но начало нового внутреннего периода ( переход от Ей к Gd) сопровождается уменьшением третьего ионизационного потенциала на 4 В. У европия впервые в первой семерке достигается устойчивая наполовину заполненная 4 / - оболочка. У гадолиния же при той же устойчивой 4 / - оболочке появляется один электрон на 5 / - оболочке, который намного легче удаляется, потому что этот электрон делает стабильную 5ДО - оболочку неустойчивой. Для элементов, следующих за Gd, вновь наблюдается монотонное возрастание третьего ионизационного потенциала вследствие лантаноидного сжатия. Вследствие стабильности 4 / оболочки европий часто функционирует в степени окисления 2 за счет 6в2 - электронов, а один из семи неспаренных электронов на 4 / юболочке участвует в образовании связей в более жестких условиях. Для его аналога иттербия картина схожая, только в качестве устойчивой выступает уже полностью заселенная 4 / 4-оболочка. В случае самария и тулия, находящихся левее указанных выше Ей и Yb, 4 - и 4 / - оболочки близки к достижению стабильного состояния, а потому в основном проявляют характеристические степени окисления. Но эти же элементы в более мягких условиях могут быть в степени окисления 2 за счет 6 электронов при квазистабильных 4f - и 4 / 3-оболочках. Для элементов начала внутренних периодов - La и Gd - наблюдается только степень окисления 3 вследствие устойчивости 4 / - и 4 / г-оболочек, полностью вакантной или наполовину заполненной. А электронами, участвующими в химическом взаимодействии, у них являются 5Рб52 - электроны, т.е. по три электрона. Следует отметить, что заполненные 6-орбитали также должны быть стабильны, но для лантана и лантаноидов электроны на них являются внешними, а потому слабее связанными с ядром и вследствие этого наиболее подвижными. [16]
В химии редкоземельных элементов наиболее ярко проявляется внутренняя периодичность, особенно для производных в характеристической степени окисления. Объяснение этому факту было дано в гл. Для иллюстрации внутренней периодичности в табл. 5 приведены цвет гидратированных ионов Э3, стандартные энергии Гиббса образования трифторидов и проявляемые степени окисления. Наблюдается удивительная аналогия в свойствах элементов, находящихся друг под другом. В каждой семерке, составляющей внутренний период, ионизационные потенциалы третьего порядка монотонно растут ( см. табл. 3) с уменьшением атомных радиусов в результате лантаноидной контракции. Но начало нового внутреннего периода ( переход от Ей к Gd) сопровождается уменьшением третьего ионизационного потенциала на 4 В. У европия впервые в первой семерке достигается устойчивая наполовину заполненная 4 / 7-оболочка. У гадолиния же при той же устойчивой 4 / - оболочке появляется один электрон на Sd-оболочке, который намного легче удаляется, потому что этот электрон делает стабильную 5d0 - oбoлoчкy неустойчивой. Для элементов, следующих за Gd, вновь наблюдается монотонное возрастание третьего ионизационного потенциала вследствие лантаноидного сжатия. Благодаря стабильности указанной 4 / 7-оболочки европий часто функционирует в степени окисления 2 за счет б52 - электронов, а один из семи неспаренных электронов на 4 / 7-оболочке участвует в образовании связей в более жестких условиях. Для его аналога иттербия картина схожая, только в качестве устойчивой выступает уже полностью заселенная 4 / 14-обо-лочка. [17]
В химии редкоземельных элементов наиболее ярко проявляется внутренняя периодичность, особенно для производных в характеристической степени окисления. Объяснение этому факту было дано в § 5 гл. Для иллюстрации внутренней периодичности в табл. 25 приведены цвет гидратированных ионов Э3, стандартные энергии Гиббса образования трифторидов и проявляемые степени окисления. В каждой семерке, составляющей внутренний период, ионизационные потенциалы третьего порядка монотонно растут ( см. табл. 24) с уменьшением атомных радиусов вследствие лантаноидной контракции. Но начало нового внутреннего периода ( переход от Ей к Gd) сопровождается уменьшением третьего ионизационного потенциала на 4 В. У европия впервые в первой семерке достигается устойчивая наполовину заполненная 4 / - оболочка. У гадолиния же при той же устойчивой 4 / - оболочке появляется один электрон на бсйэболочке, который намного легче удаляется, потому что этот электрон делает стабильную 5 -оболочку неустойчивой. Для элементов, следующих за Gd, вновь наблюдается монотонное возрастание третьего ионизационного потенциала вследствие лантаноидного сжатия. Вследствие стабильности 4 / - оболочки европий часто функционирует в степени окисления 2 за счет 6в2 - электронов, а один из семи неспаренных электронов на 4 / - оболочке участвует в образовании связей в более жестких условиях. Для его аналога иттербия картина схожая, только в качестве устойчивой выступает уже полностью заселенная 4 / 4-оболочка. В случае самария и тулия, находящихся левее указанных выше Ей и Yb, 4 / - и 4 / 3-оболочки близки к достижению стабильного состояния, а потому в основном проявляют характеристические степени окисления. Но эти же элементы в более мягких условиях могут быть в степени окисления 2 за счет 6я2 - электронов при квазистабильных 4f - и 4 / 3-оболочках. Для элементов начала внутренних периодов - La и Gd - наблюдается только степень окисления 3 вследствие устойчивости 4 / - и 4 / 7-оболочек, полностью вакантной или наполовину заполненной. А электронами, участвующими в химическом взаимодействии, у них являются б бвЗ - электроны, т.е. по три электрона. Следует отметить, что заполненные Gs-орбитали также должны быть стабильны, но для лантана и лантаноидов электроны на них являются внешними, а потому слабее связанными с ядром и вследствие этого наиболее подвижными. [18]
Таким образом, в группе лантанидов замечается определенная внутренняя периодичность, позволяющая разделить группу на две подгруппы. Первая подгруппа называется цериевой; к ней относятся лантан, церий, празеодим, неодим, прометий, самарий, европий. Вспомним, что начало истории открытия редкоземельных элементов, а также скандия и иттрия, было положено выделением церитовых и иттрие-вых земель. Элементы цериевой группы называют также легкими, а иттриевой - тяжелыми редкоземельными элементами. [19]
На этом мы покончим с вопросом о внутренней периодичности среди редкоземельных элементов; эта идея для дальнейшего своего развития требует глубокого сопоставления свойств лантаноидов и второго редкоземельного семейства - актиноидов. [20]
Между элементами больших периодов в свою очередь выявляется внутренняя периодичность в изменении валентности, в связи с чем каждый период разделен на два ряда. Период заканчивается инертным элементом криптоном. [21]
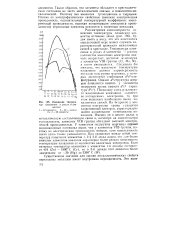 |
Изменение температур плавления в рядах d - эле. [22] |
Существенное значение для оценки металлохимических свойств переходных металлов имеет внутренняя периодичность. [23]
Легко заметить, что это свойство РЗЭ также подчиняется внутренней периодичности: элементы цериевой группы обладают значительно меньшим парамагнетизмом, чем элементы ит-триевой группы. Торий в этом отношении является аналогом церия. Важно отметить, что гадолиний обладает ферромагнитными свойствами, подобно железу, кобальту и никелю. [24]
Структура атомов РЗЭ и проявляемая ими валентность указывает на внутреннюю периодичность среди них. Наиболее устойчивые электронные конфигурации наблюдаются у La, Gd, Lu; это как бы благородные газы во внутренней периодической системе. Лантаноиды, стоящие близко к лантану, или гадолинию, или лютецию, стремятся к более устойчивой конфигурации благородного газа. [25]
 |
Схема валентных состояний редкоземельных элементов ( пунктир - предполагаемые валентности. [26] |
Структура атомов РЗЭ и проявляемая ими валентность указывают на внутреннюю периодичность среди них. Наиболее устойчивые электронные конфигурации наблюдаются у лантана, гадолиния и лютеция. Они представляют собой как бы благородные газы в этой внутренней периодической системе. [27]
Структура атомов РЗЭ и проявляемая ими валентность указывает на внутреннюю периодичность среди них. Наиболее устойчивые электронные конфигурации наблюдаются у La, Qd, Lu; это как бы благородные газы во внутренней периодической системе. Лантаноиды, стоящие близко к лантану, или гадолинию, или лютецию, стремятся к более устойчивой конфигурации благородного газа. [28]
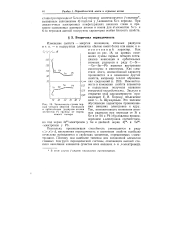 |
Зависимость суммы первых четырех энергий ионизации и орбитальных радиусов атомов элементов IV группы от порядкового номера. [29] |
Поскольку проникающая способность уменьшается в ряду s p d, внутренняя периодичность в изменении свойств наиболее отчетливо проявляется в свойствах элементов, определяемых s - элек-тронами. [30]
Страницы: 1 2 3 4