Вторичная периодичность
Cтраница 1
Вторичная периодичность проявляется как в химических, так и в физических свойствах. [1]
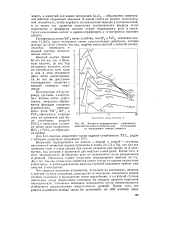 |
Вторично-периодическая зависимость. [2] |
Вторичная периодичность на низких - первой и второй - ступенях окисления d - элементов хорошо проявлена в химии Zn, Cd и Hg, так как эти элементы стоят в конце декады при сильно развитом уже экране из d - элек-тронов, под который и проникают два внешних s - электрона. Кроме того, в силу заполненности З - оболочки дело не осложняется из-за расщепления d - уровней. Несколько слабее вторичная периодичность заметна на Си, Ag и Аи, так как атомы этих элементов имеют только по одному валентному s - электрону, а возбуждение более высоких ступеней окисления требует уже участия d - электронов. [3]
Вторичная периодичность этого типа в случае лантаноидов приводит также к двум параллельным кривым, Но этой же ири-чине Th с Ой2 - электронами отличается уменьшением радиуса. [4]
Вторичная периодичность, вызванная второй из названных причин, выражается в нелинейном изменении орбитальных радиусов атомов с увеличением Z в пределах отдельных подгрупп Системы. Поэтому па рис. 3 г0рб Na лежит не на продолжении прямой Н - Li, а резко вправо от нее. [5]
Вторичная периодичность выражается обычно в значительно более высоких значениях 1У для элементов 2-го периода по сравнению с элемента-ми остальных периодов тех же подгрупп и других изменениях Ti в пределах каждой из подгрупп. [6]
Вторичная периодичность примерно в пять дней, более ярко выраженная в восточном Непале, вероятно, вызвана перемещающимися на запад депрессиями над северной Индией. Между этими периодами относительно сухо, за исключением тех дней, когда наблюдаются местные конвективные ливни. Даже при этом в горах восточного Непала в июле и августе обычно отмечается по 27 дождливых дней ( 2 5 мм / ч) со средней интенсивностью около 20 мм / сут. В высоко расположенных долинах суммы и интенсивности осадков резко снижаются, и, например, в Намче-Базаре ( 3400 м) летом выпадает лишь 8 мм осадков в сутки. [7]
Вторичная периодичность в таблице элементов Менделеева / / ЖОХ. [8]
Вторичная периодичность отражается не только на химическом поведении веществ, но и на физических свойствах простых тел. [9]
Поэтому вторичная периодичность проявляется резче всего в-свойствах соединений основных подгрупп, отвечающих валентности, равной или близкой номеру группы. [10]
Проблема вторичной периодичности должна изучаться в единстве с проблемой кайносимметрии и теснейшим образом соприкасаться с широким понятием об индивидуальности в свете явлений корреляции электронных движений. [11]
Явление вторичной периодичности в группах элементов периодической системы впервые было подмечено русским ученым Е. В. Бироном в 1913 г. Особенно отчетливо оно проявляется у галогенов. Так, по прочности кислородных соединений бром более похож на фтор, а хлор - на йод. Причина этого заключается в поляризационных взаимодействиях. Группа галогенов как бы подразделяется на две: фтор-бром и хлор - йод. [12]
Причины вторичной периодичности не вполне ясны. Их связывают с упрочнением самых внешних валентных электронов. Эти упрочнения сильнее всего сказываются на s - электронах, менее на р-электронах и менее всего на tf - электронах. Поэтому как бы увеличивается эффективный заряд ядра, в результате чего внешние валентные s - элек-троны сильнее притягиваются. [13]
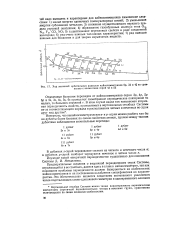 |
Ход значений орбитальных радиусов кайносимметриков 2р, 3d и 4 / j по срав. [14] |
Изучение такой вторичной периодичности существенно для понимания Системы Д. И. Менделеева. [15]
Страницы: 1 2 3 4 5