Вторичная периодичность
Cтраница 4
В отличие от других руководств по неорганической химии для обоснования вторичной периодичности, уникальности химии водорода, специфики первого ряда переходных металлов и лантаноидов широко привлекается учение о кайносимметрии электронных орби-талей и кайносимметричных элементах. Химические, физико-химические и физические свойства веществ интерпретируются в зависимости от химического и кристаллохимического строения. Такой подход дает ключ к решению актуальной научно-практической проблемы химии - получения новых материалов с запрограммированными свойствами. В целом, в книге получает дальнейшее развитие учение о постоянстве и переменности состава при химической организации вещества, о взаимосвязи и взаимообусловленности между химическим и крнсталлохимическим строением, с одной стороны, и свойствами веществ - с другой. [46]
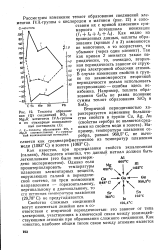 |
Теплоты образования ( Q соединений RO2 и Mg2R элементов IVA-группы и их суммарные ионизационные потенциалы ( /. [47] |
Свойства сложных соединений могут изменяться линейно или в соответствии с вторичной периодичностью: это зависит от типа электронов, участвующих в химической связи между взаимодействующими атомами при образовании сложного соединения. [48]
Так как кривая 2 меняется также периодически, то, очевидно, вторичная периодичность зависит от структуры электронной оболочки атомов. В случае изменения свойств в группе по закономерности вторичной периодичности нельзя использовать интерполяцию - ошибка здесь неизбежна. [49]
 |
Энергетическое различие ns - и np - уровней атомов р-элементов VI группы и средняя энергия связей в молекулах их гексафторидов. [50] |
В характере изменения энергетического различия ns - и пр-орби-талей в подгруппе проявляется явно выраженная вторичная периодичность. Как видно из табл. 28, энергетическая разность между ns - и np - уровнями для элементов 4-го периода выше, чем для элементов 3-го и 5-го периодов. Следовательно, соединения, отвечающие высшей степени окисления у Зр - и 5р - элементов, должны быть устойчивее, чем у 4р - элементов. [51]
 |
Энергетическое различие ns - и np - уровней атомов р-элементов VI группы и средняя энергия связей в молекулах их гексафторидов. [52] |
В характере изменения энергетического различия ns - и пр-орби-талей в подгруппе проявляется явно выраженная вторичная периодичность. Как видно из табл. 28, энергетическая разность между ns - и яр-уровнями для элементов 4-го периода выше, чем для элементов 3-го и 5-го периодов. Следовательно, соединения, отвеяающие высшей степени окисления у Зр - и 5р - элементов, должны быть устойчивее, чем у 4р - элементов. [53]
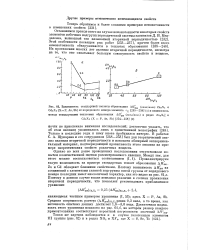 |
Зависимость стандартной теплоты образования ДЯ 98 ( ккал / молъ Zn3X2 и. [54] |
В работах С. А. Щукарева и его сотрудников [248-253] был дан теоретический анализ явления вторичной периодичности и накоплен обширный экспериментальный материал, подтверждающий правильность этого анализа на примере энергетических свойств различных веществ. [55]
Таким образом, ряд H2SO4 - H2SeO4 - H6TeO6 дает типичный пример вторичной периодичности. [56]
Таким образом, ряд H2SO4 - H2SeO4 - Н6ТеО6 дает типичный пример вторичной периодичности. [57]
Вследствие того что у брома имеет место 18-электронный предвнешний слой, он обнаруживает явную вторичную периодичность, особенно в своих кислородных соединениях. При этом 10 электронов 3 / - орбиталей являются кай несимметричными, поэтому сильнее притянуты к атомному ядру. Это главная причина, почему только сравнительно недавно были получены производные брома в степени окисления 7, в частности бромная кислота HBrO-i. Предвнешнйе ( - электроны атома иода не относятся к кайносимметричным и не удивительно, что соединения иода ( 7) стабильны и давно известны. [58]
Вследствие того что у брома имеет место 18-электронный предвнешний слой, он обнаруживает явную вторичную периодичность, особенно в своих кислородных соединениях. При этом 10 электронов 3йэрбиталей являются кайносиммет-ричными, поэтому сильнее притянуты к атомному ядру. Предвнешние - электроны атома иода не относятся к кайносимметричным и не удивительно, что соединения иода ( 7) стабильны и давно известны. [59]
При систематическом термохимическом исследовании соединений металлов с элементами главных подгрупп периодической системы была обнаружена вторичная периодичность в их энтальпиях образования, проявляющаяся в чередовании возрастания и уменьшения величины ДЯ [ 5бр при увеличении порядковых номеров элементов. [60]
Страницы: 1 2 3 4 5