Перксенат
Cтраница 1
Перксенаты Na4XeO6 - 8H2O, Na4XeO6 - 6H20, Ва2ХеО6 - 1 5Н2О малорастворимы в воде. [1]
Перксенаты Na4XeO6 - 8H2O, Na4XeO6 - 6H2O, Ba2XeO6 - l 5H2O малорастворимы в воде. [2]
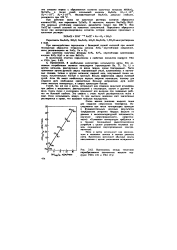 |
Взаимосвязь между теплотами парообразования элементных веществ подгрупп VIIIA О и VIIA ( Гг. [3] |
Перксенаты Na4XeO6 SHjO, Na XeCU - 6HjO, ВагХеОб - l HjO мало растворимы в воде. [4]
Перксенаты 245 Перлит II - 329 Перлон 560 Пермаллой II - 333 Перманганаты 289 ел. [5]
Перксенаты образуются не только при диспропорционировании НХеС4, но также при его окислении озоном, Растворы перксена-тов имеют желтый цвет. [6]
Перксенат натрия, впервые полученный [52] в 1963 г., имеет стандартный электродный потенциал в кислом растворе 3 0 В. [7]
Перксенаты бария, лития и натрия совершенно нерастворимы в присутствии избытка соответствующей щелочи и легко выделяются из маточного раствора. Перксенаты калия, рубидия и цезия более растворимы, и их соответственно труднее выделить. В таблице приведены растворимости этих солей в воде. Растворимость смешанной соли К4Хе06 - 2ХеОз значительно меньше растворимости чистого перксената калия, поэтому при синтезе эта смешанная соль может выкристаллизоваться из раствора. Это ярко-желтое, сильно взрывчатое вещество, в то время как сами перксенаты щелочных металлов устойчивы и почти бесцветны. [8]
Осадки перксенатов обычно содержат 2 - 8 молей кристаллизационной воды на 1 моль соли. При более высоких температурах перксенаты разлагаются с выделением ксенона, кислорода, окисла или перекиси металла. [9]
Анион этого перксената имеет структуру слегка искаженного октаэдра со средним расстоянием d ( XeO) 1 85 А. Тетранатрийперксенат может быть выделен в виде бесцветного кристаллогидрата с 6 или 8 Н20, который обезвоживается около 100 С, а бурно разлагается лишь при 360 С. Соль эта малорастворима в воде ( растворимость около 0 025 / И), но сильно гидролизуется, давая щелочную реакцию. [10]
При нагревании перксената бария с концентрированной HaSC образуется тетроксид ксенона в виде неустойчивого взрывчатого газа. [11]
В щелочных растворах перксенаты лишь очень медленно восстанавливаются водой и образуют НХеО в качестве основного иона. [12]
Из водного раствора перксенат натрия выделяется в виде бесцветного кристаллогидрата Na4XeOe 6Н2О, который обезвоживается при 100 С. [13]
Как получают ксенаты и перксенаты. [14]
Некоторые многозарядные катионы образуют почти нерастворимые перксенаты, которые можно выделить в виде осадка, добавив в раствор, содержащий эти ионы, растворимый перксенат. [15]
Страницы: 1 2 3