Перксенат
Cтраница 2
Известны ксенаты, содержащие Xe ( VI), и перксенаты [ производные Xe ( VIII) ], например CsHXe04 синтезирован из ХеОз. CsOH в присутствии ионов F -, а гидратированные соли, содержащие ион Хе054, получены при взаимодействии XeF6 и гндроксидов щелочных металлов. [16]
Рентгенографические исследования кристалла Na4XeO6 - 6H2O показали, что ион перксената имеет структуру правильного октаэдра с длиной связи Хе-О, равной 184 пм. [17]
Рентгенографические исследования кристалла Na4XeOe - 6H20 показали, что ион перксената имеет структуру правильного октаэдра с Длиной связи Хе - О, равной 1 84 А. [18]
Соли первой кислоты называют ксенонатамн или ксенатами, а второй - перксенатами. При нагревании до 100 С этот кристаллогидрат обезвоживается, и получается безводная соль, которая устойчива до температур выше 300 С. [19]
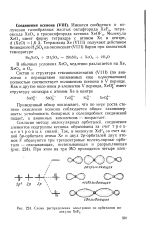 |
Схема распределения электронов по орбиталям молекулы XeF2. [20] |
Состав и структура гексаоксоксенатов ( VIII) ( по аналогии с периодатами называемых еще перксенатами) полностью соответствует положению ксенона в V периоде. [21]
При действии озона на щелочные растворы ксенатов образуются к сенаты ( VIII), или перксенаты Э ХеОб. Это довольно устойчивое соединение, разлагается только при 300 С. Ион ХеО - р) - самый сильный из известных окислителей. [22]
Состав и структура гексаоксоксенатов ( VIII) ( по аналогии с перио-датами, называемых еще перксенатами) полностью соответствует положению ксенона в 5 - м периоде. [23]
Состав и структура гексаоксоксенатов ( VIII) ( по аналогии с перио-датами, называемых еще перксенатами) полностью соответствуют положению ксенона в 5 - м периоде. [24]
Хотя сами эти кислоты неустойчивы, их соли - ксенаты ( например, NaeXeO6, Ва3ХеО6) и перксенаты ( например, Na4XeO6, Ba2XeOe) - при комнатной температуре представляют собой достаточно устойчивые кристаллические вещества. [25]
Хотя сами эти кислоты неустойчивы, их соли - ксенаты ( например, Na4XeOe и Ва3ХеО6) и перксенаты ( например, Na6XeO6, Ba2XeO6) - при комнатной температуре представляют собой достаточно устойчивые кристаллические вещества. [26]
Хотя сами эти кислоты неустойчивы, их соли - ксенаты ( например, Na4XeO6, Ва3ХеО6) и перксенаты ( например Na6XeOe, Ba2XeO6) - при комнатной температуре представляют собой достаточно устойчивые кристаллические вещества. [27]
Ат ( Ш) относятся также арсенат АтА О4, вана-дат АтУО4, ниобат АтМЪО4, фосфат АтРО4 - 0 5Н2О, перксенат Ат4ХеО6 - 40Н2О и др. Выделены кристал-лич. [28]
Некоторые многозарядные катионы образуют почти нерастворимые перксенаты, которые можно выделить в виде осадка, добавив в раствор, содержащий эти ионы, растворимый перксенат. [29]
Из кислородных соединений, помимо оксида ксенона ( VI) ХеОз, получены оксид ксенона ( VIII) ХеО4, а также соответствующие им кислоты - HeXeOg и Н4ХеОб - Хотя сами эти кислоты неустойчивы, их соли - ксенаты ( например, На4ХеОб, ВазХеОв) и перксенаты ( например NagXeOg, Ba2XeOg) - при комнатной температуре представляют собой достаточно устойчивые кристаллические вещества. [30]
Страницы: 1 2 3