Пероксигидрат
Cтраница 1
Пероксигидраты щелочно - и редкоземельных элементов. [1]
Пероксигидрат состава Li2O2 - H2CV2H2C) получают по реакции между этилатом лития LiOC2H6 и перекисью водорода в этиловом спирте. [2]
Для пероксигидратов перекисей на кривых нагревания обязательно наличие экзотермического эффекта при 45 - 75 С, связанного с разложением кристаллизационной перекиси водорода. Затем следует эффект обезвоживания и наконец характерный эндотермический эффект разложения самой перекиси. На рис. 9 приведена кривая нагревания дипер-оксигидрата перекиси кальция. [3]
Кроме пероксигидратов щелочных боратов, имеют значение перокси-тидраты боратов двухвалентных металлов. Последние, например перо-ксигидраты боратов щелочноземельных металлов, трудно растворимы в противоположность пероксигидратам боратов щелочных металлов и употребляются поэтому в качестве дезинфицирующих порошков и как средство для чистки зубов. [4]
Кроме пероксигидратов щелочных боратов, имеют значение перокси-гидраты боратов двухвалентных металлов. Последние, например перо-ксигидраты боратов щелочноземельных металлов, трудно растворимы в противоположность пероксигидратам боратов щелочных металлов и употребляются поэтому в качестве дезинфицирующих порошков и как средство для чистки зубов. [5]
Кроме пероксигидратов щелочных боратов, имеют значение пероксигидраты боратов двухвалентных металлов. Последние, например пероксигидраты боратов щелочноземельных металлов, трудно растворимы в про-ривоположность пероксигидратам боратов щелочных металлов и употребляются поэтому в качестве дезинфицирующих порошков и как средство для чистки зубов. [6]
Несомненно, существующие пероксигидраты правильнее всего представлять как соединения с водородной связью, аналогичные вышеупомянутому классу соединений с анионной водой. Механистически процесс образования водородных связей прост. Природа водородных связей в перекиси водорода кратко проапализированапри рассмотрении ассоциативных свойств перекиси на стр. Показано, каким образом электроотрицательный характер кислорода, полярность связи ОН и малые размеры атома водорода способствуют образованию таких связей. Указывается также, что эти связи слишком слабы для длительного сохранения в газовой или жидкой фазе; они сохраняются только в твердых телах. Из этих свойств вытекает, что пероксигидраты, так же как гидраты, могут быть образованы соединениями, содержащими высокоэлектроотрицательные атомы, например азот, кислород и фтор. [7]
При взаимодействии пероксигидратов с водой кристаллизационная перекись водорода переходит в раствор и может быть определена количественно перманганатометрически. [8]
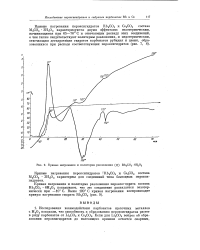 |
Кривые нагревания и политерма разложения ( X КЬзСОз-6Н202. [9] |
Кривая нагревания и политерма разложения пероксигидрата состава Rb2G03 6Н202 показывают, что это соединение распадается экзотермически при - 10 С. [10]
Перфосфаты отличаются от известных в большом количестве пероксигидратов различных фосфатов ( например, Na2HP04 - H202 - пероксигидрат кислого фосфорнокислого натрия) некоторыми характерными для них реакциями, например окислением Мп до MnOJ. От над-фосфорной кислоты она отличается тем, что вызывает, как и ЩС, желтое окрашивание раствора сульфата титана, однако она не дает, подобно перекиси водорода, реакции образования надхромовой кислоты. [11]
Необходимо отметить, что некоторые гидроперекиси могут быть отнесены к пероксигидратам, другие к пероксокислотам. Например, соединение NaOOH может быть представлено в виде димера Na202 Н202, а соединение ( OH) gTiOOH можно рассматривать как пероксокислоту. К комплексным перекисным соединениям следует отнести те, в которых пероксо-группа, как таковая или в виде Н202 и Н02, соединена с элементом, образующим перекисное соединение не ионной, а координативной связью, К комплексным перекисным соединениям относятся также аддитивные соединения с кристаллизационной перекисью водорода. [12]
Ричардсом [5], показало, что это соединение построено по типу пероксигидрата карбоната натрия Na2C03 Н202 и не является солью какой-либо пероксокарбоновой кислоты. [13]
В большинстве случаев для этого используют реакцию Ризенфельда, позволяющую отличать пероксосоли от пероксигидратов на том основании, что настоящие пероксосоли в отличие от Н202, а также продуктов ее присоединения выделяют 12 из нейтральных растворов KI уже на холоду. Но даже и в этих условиях реакция Ризенфельда по указанным выше причинам не пригодна для отличия пероксоборатов от пероксигидратов боратов. [14]
В большинстве случаев для этого используют реакцию Ризенфельда, позволяющую отличать пероксосоли от пероксигидратов на том основании, что настоящие пероксо-соли в отличие от Н202, а также продуктов ее присоединения выделяют 12 из нейтральных растворов KI уже на холоду. Но даже и в этих условиях реакция Ризенфольда по указанным выше причинам не пригодна для отличия пероксоборатов от пероксигидратов боратов. [15]
Страницы: 1 2 3 4