Пероксигидрат
Cтраница 2
Протравливание адгезивного слоя производится в кислых хром-содержащих растворах или щелочных растворах с использованием пероксигидрата мочевины, пероксида водорода или перманганата калия в качестве окислителей, например обработкой в растворе, содержащем 40 - 45 г / л перманганата калия и 40 - 50 г / л едкого кали при температуре 60 С в течение 5 - 7 мин. [16]
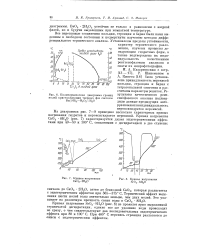 |
Политермическая диаграмма границ.| Кривая нагревания Са02 8Н20.| Кривая нагревания Sr02 8Н20. [17] |
На диаграммах рис. 7 - 9 приведено несколько характерных кривых нагревания гидратов и пероксигидратов перекисей. [18]
Значительные количества перекиси водорода применяют также для приготовления других отбеливающих веществ, например пероксигидрата тетрабората натрия ( см. стр. В смеси с гидразингидратом, метанолом или углево дородами она применяется в качестве реактивного горючего и для других подобных целей. Уже перед последней мировой войной ежегодная мировая продукция составляла около 30 000 т 30 % - ной перекиси водорода. [19]
Действием Н202 на растворы германатов щелочных металлов получают, как и в случае кремния, пероксигидраты. Шварц ( 1930) приготовил пероксигидраты германатов K2Ge206 - 2H202 - 2H2O, Na2Ge2O6 - 2H2O2 - 2H2O и Na2GeO3 - 2H2O2 - 2H2O в кристаллической форме и доказал ( 1935), что при этом речь идет о продуктах присоединения перекиси водорода, а не о пероксисолях. [20]
Действием Н202 на растворы германатов щелочных металлов получают, как и в случае кремния, пероксигидраты. Шварц ( 1930) приготовил пероксигидраты германатов K2Ge205 - 2H202 - 2H20, Na2Ge2O6 - 2H202 - 2H20 и Na2Ge03 2H202 - 2H20 в кристаллической форме и доказал ( 1935), что при этом речь идет о продуктах присоединения перекиси водорода, а не о пероксисолях. [21]
Действием Н202 на растворы германатов щелочных металлов получают, кпк и в случае кремния, пероксигидраты. Шварц ( 1930) приготовил1 пероксигидраты германатов K2Ge205 - 2H202 - 2H20, Na2Ge205 - 2H202 - 2H20 и Na2Ge03 X X 2Н202 - 2Н20 в кристаллической форме и доказал ( 1935), что при этом речь идет о продуктах присоединения перекиси водорода, а не о пероксисолях. [22]
Молекула перекиси водорода может присоединяться как целое к другой молекуле с образованием аддитивных соединений или пероксигидратов, аналогичных гидратам. [23]
Такого рода аддитивные соединения перекиси водорода, содержащие также гидратную воду, можно называть гидратами пероксигидратов. [24]
Представляет интерес применение для предстерилизационной обработки медицинского оборудования средств, содержащих перекисные соединения, в частности пероксигидраты. Одно такое средство - Персинтамм - отобрано для дальнейшего исследования. [25]
Перфосфаты отличаются от известных в большом количестве пероксигидратов различных фосфатов ( например, Na2HP04 - H202 - пероксигидрат кислого фосфорнокислого натрия) некоторыми характерными для них реакциями, например окислением Мп до MnOJ. От над-фосфорной кислоты она отличается тем, что вызывает, как и ЩС, желтое окрашивание раствора сульфата титана, однако она не дает, подобно перекиси водорода, реакции образования надхромовой кислоты. [26]
Разница между потенциалами пероксокарбоната и Н202 составляет 300 - 400 же, что служит основой для различения истинных пероксокарбонатов и пероксигидратов, которые специфического потенциала не имеют. [27]
Группа веществ, которые получаются из растворов карбонатов и перекиси водорода высаливанием при пониженной температуре, является по мнению большинства исследователей типичными пероксигидратами карбонатов. [28]
Параметры сигналов O2 - ( g; Agz, ДНЭф), образовавшихся при высокотемпературной собственной хемосорбции оксидов, были сопоставлены с параметра-ми О2 - в соответствующих объемных пероксигидратах. [29]
Пероксигидраты металлов были получен осаждением гидроксидов в присутствии свежепере наннОго пероксида водорода. Все это позволяло получать воспроизводимь количественные адсорбционно-каталитические даннь на поверхности оксидов, освобожденных от органиче ких загрязнений и основной части карбонатных, и ги роксидных групп. [30]
Страницы: 1 2 3 4