Пероксид - водород
Cтраница 1
Пероксид водорода, образующийся в результате ферментативного окисления глюкозы, реагирует с иодидом в присутствии молибдена ( VI) в качестве катализатора с образованием трииодида, который сильно поглощает свет при 360 нм. [1]
Пероксид водорода как высокоактивный и экологически чистый окислитель может достаточно эффективно применяться для очистки сточных вод на локальных очистных сооружениях в ряде производств нефтехимии. Наиболее перспективный представляется использование на предприятиях, где имеется его производство. [2]
Пероксид водорода и гидроперокси-анион являются прекрасными нуклеофилами, уже содержащими группировку - ООН. [3]
Пероксид водорода, 30 % - ный раствор, не стабилизированный добавлением фосфатов. [4]
Пероксид водорода заготавливают в виде 30 % - но-го раствора, который по мере необходимости разбавляют до нужной концентрации. Разбавление производится, в частности, в аптеках. Пероксид водорода оказывает на кожу отбеливающее действие. [5]
Пероксид водорода изготавливается также в виде таблеток гидроперита, которые, растворяясь в воде, образуют раствор пероксида водорода. [6]
Пероксид водорода применяется, как правило, в виде 1 5 - 2 % - ных растворов в дистиллированной воде, в которую добавлены слабые органические кислоты и поверхностно-активное вещество. [7]
Пероксид водорода - вещество непрочное, даже при комнатной температуре постепенно разлагается с выделением атомарного ( активного) кислорода: Н2О2 Н2О О. [8]
Пероксид водорода обычно применяют в виде 30 % - го водного раствора. [9]
Пероксид водорода разлагается диоксидом марганца, хрома, цинка. [10]
Пероксид водорода был впервые получен в 1818 г. Л. Ж. Те-наром; первое промышленное производство Н2С2 было пущена в 1879 г. Вначале пероксид водорода получали взаимодействием фтороводородной или кремнефтороводородной кислоты с пер-оксидом бария. Затем были разработаны электрохимические способы получения Н2О2, включающие электролиз с получением пероксодисерной кислоты, либо пероксодисульфата аммония или; пероксодисульфата калия и гидролиз этих соединений. [11]
Пероксид водорода и его производные получают как химическим, так и электрохимическим методом. [12]
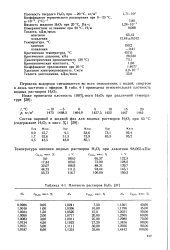 |
Плотность растворов ЬЬСЬ 37 ]. [13] |
Пероксид водорода смешивается во всех отношениях с водой, спиртом и лишь частично с эфиром. В табл. 4 - 1 приведена относительная плотность водных растворов Ь СЬ. [14]
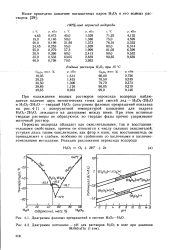 |
Диаграмма фазовых превращений в системе НгСЬ - Н2О.| Диаграмма потенциал - рН для растворов Н2О2 в воде при давлении. [15] |
Страницы: 1 2 3 4 5