Пероксид - водород
Cтраница 4
Пероксид водорода может быть получен как химическим, так и электрохимическим путем. [46]
 |
Строение молекулы НО. [47] |
Пероксид водорода ( перекись водорода) Н2О2 получают несколькими способами. В промышленности используется, в частности, электрохимическое окисление серной кислоты ( при высокой плотности тока, низкой. [48]
Пероксид водорода и гидроперокси-анион являются прекрасными нуклеофилами, уже содержащими группировку - ООН. [49]
Пероксид водорода - хороший окислитель ( см. разд. Избыток пероксида обычно разлагают кипячением щелочного раствора. Разложение ускоряется при введении катализаторов, например солей никеля, иодида, платиновой черни. [50]
Пероксид водорода широко используют в качестве окислителя, например, для отбеливания тканей и других материалов. Разрушая красящие вещества, он почти не затрагивает отбеливаемый материал. [51]
Пероксид водорода получают электролизом растворов серной кислоты. [52]
Пероксид водорода и его производные получают как химическим, так и электрохимическим методом. [53]
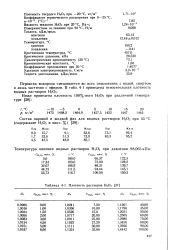 |
Плотность растворов ЬЬСЬ 37 ]. [54] |
Пероксид водорода смешивается во всех отношениях с водой, спиртом и лишь частично с эфиром. В табл. 4 - 1 приведена относительная плотность водных растворов Ь СЬ. [55]
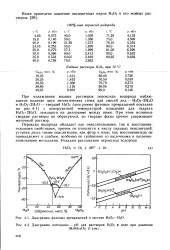 |
Диаграмма фазовых превращений в системе НгСЬ - Н2О.| Диаграмма потенциал - рН для растворов Н2О2 в воде при давлении. [56] |
Пероксид водорода обладает как окислительными, так и восстановительными свойствами, причем он относится к числу сильных окислителей, уступая лишь таким окислителям, как фтор и озон; как восстановитель он принадлежит к слабым, особенно по сравнению со щелочными и щелочноземельными металлами. [57]
Пероксид водорода не ядовит, но его концентрированные растворы ( 10 %) вызывают раздражение кожи и дыхательных путей. При соприкосновении с кожей отмечается ее повеление, сопровождающееся зудом и чувством жжения. При тщательной отмывке эти явления проходят. Пары пероксида водорода вызывают слезотечение и раздражение слизистых оболочек носа и горла. [58]
Пероксид водорода и пероксиды металлов благодаря их окислительным свойствам используются в различных отраслях народного хозяйства. В сельском хозяйстве с их помощью ускоряют созревание семян, бо-рятся с вредителями культур, в пищевой промышленности консервируют продукты. Разбавленные растворы пероксида водорода применяются в медицине как антисептическое средство, концентрированные растворы используются в военной и реактивной технике. [59]
Пероксид водорода и пероксиды металлов благодаря их окислительным свойствам используются в различных отраслях народного хозяйства. В сельском хозяйстве с их помощью ускоряют созревание семян, борятся с вредителями, в пищевой промышленности консервируют продукты. Водные растворы пероксида водорода используются в молочной промышленности для повышения стойкости молока и сыворотки, а также для дезинфекции молочного оборудования и инвентаря. Разбавленные растворы перекиси водорода применяются в медицине как антисептическое средство, концентрированные растворы используются в военной и реактивной технике. [60]
Страницы: 1 2 3 4 5