Пероксид - водород
Cтраница 2
Пероксид водорода обладает как окислительными, так и восстановительными свойствами, причем он относится к числу сильных окислителей, уступая лишь таким окислителям, как фтор и озон; как восстановитель он принадлежит к слабым, особенно по сравнению со щелочными и щелочноземельными металлами. [16]
Пероксид водорода не ядовит, но его концентрированные растворы ( 10 %) вызывают раздражение кожи и дыхательных путей. При соприкосновении с кожей отмечается ее повеление, сопровождающееся зудом и чувством жжения. При тщательной отмывке эти явления проходят. Пары пероксида водорода вызывают слезотечение и раздражение слизистых оболочек носа и горла. [17]
Пероксид водорода переводит гидрохиноны в хиноны в присутствии, каталитических количеств более эффективного окислителя, который собственно и взаимодействует с гидрохиноном, тогда как Н2Оа обеспечивает регенерацию катализатора. [18]
Пероксид водорода широко используется в качестве инициа тора полимеризации в производстве гидрокеилсодержащих оли-годиенов. Процесс полимеризации диенов в присутствии Н202 проводится, как правило, в спиртах, которые растворяют мономер и НгОз, но осаждают образующийся полимер. Гетерогенность полимеризации осложняет изучение механизма инициирования и придает ряд особенностей протеканию самого процесса полимеризации и структуре получаемого полимера. [19]
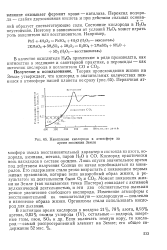 |
Накопление кислорода в атмосфере за время эволюции Земли. [20] |
Пероксид водорода - слабая двухосновная кислота и при действии сильных оснований образует соответствующие соли. Состояние кислорода в Й2О2 неустойчиво. Поэтому в зависимости от условий Н202 может играть роль окислителя или восстановителя. [21]
Пероксид водорода присоединяется сравнительно легко в присутствии катализаторов, например вольфрамовой кислоты. [22]
Пероксид водорода обычно применяют в виде 30 % - ного водного раствора. [23]
 |
Схема строения H2S2H8 2Н2О 2H2SO4 Н2О2. [24] |
Пероксид водорода образуется в качестве промежуточного продукта при горении водорода, но ввиду высокой температуры водородного пламени тотчас же разлагается на воду и кислород. [25]
Пероксид водорода получается также при действии атомарного водорода на кислород. [26]
Пероксид водорода применяют также для обновления старых картин, написанных масляными красками и потемневших от времени вследствие превращения свинцовых белил в черный сульфид свинца под действием содержащихся в воздухе следов сероводорода. [27]
 |
Схема строения H2S2O, 2H2O 2H2SO4 Н2О3. [28] |
Пероксид водорода образуется в качестве промежуточного продукта при горении водорода, но ввиду высокой температуры водородного пламени тотчас же разлагается на воду и кислород. [29]
Пероксид водорода получается также при действии атомарного водорода на кислород. [30]
Страницы: 1 2 3 4 5