Перхлорат - щелочной металл
Cтраница 3
Перхлорат лития плавится при 247 С и не разлагается с заметной скоростью до тех пор, пока температура не поднимется выше 400 С. Таким образом, LiClO - единственный из перхлоратов щелочных металлов, о котором можно сказать, что он обладает четко выраженной температурой плавления. [31]
Дегидратация стабильного при обычных температурах трягидрата и получение безводного LiClO4 до настоящего времени серьезно не изучалась. Так, по имеющимся данным [5, 6], LiClO4 является наименее устойчивым в ряду перхлоратов щелочных металлов, он обезвоживается при 95 - 190 и разлагается при - 400 С. [32]
Увеличивается производство жидкого хлора, хлоридов алюминия, кремния, титана, железа, цинка и хлоридов других металлов, применяемых в менее широких масштабах. Развивается производство хлоратов натрия, магния и калия, вырабатываются в значительных количествах хлораты, кальция и перхлораты щелочных металлов и аммония. [33]
В обзоре [19] собраны данные по растворимости солей металлов, главным образом нитратов и хлоридов, в чистых и разбавленных растворах нейтральных фосфорорганических эфиров. Растворимость внутри каждой группы солей металлов снижается с ростом атомного веса металла. Перхлораты щелочных металлов более растворимы, чем соответствующие нитраты; имеет место тенденция к увеличению растворимости от хлорида к иодиду. [34]
Однако практическое использование этих возможностей встречает определенные трудности. Прежде всего неводные-растворы обладают невысокой электропроводностью, в среднем в 10 и более раз меньшей, чем для водных растворов. Обычно употребляют перхлораты щелочных металлов или четвертичных аммониевых оснований. Низкая электропроводность неводных растворов вызывает значительные трудности, связанные с отводом тепла, и обусловливает высокий расход электроэнергии. В случае использования только катодного процесса окисление растворителя на аноде приводит к потерям дорогостоящего растворителя. Перечисленные особенности неводных растворителей в значительной степени ограничивают их применение в органическом синтезе. [35]
Соли хлорной кислоты так же, как и хлорная кислота, - соединения, богатые кислородом. Многие перхлораты в отличие от хлорной кислоты обладают достаточной стабильностью. Такие соли, как перхлораты щелочных металлов и, главным образом, перхлорат аммония широко используются в качестве окислителей для ракетных топлив и в пиротехнике. Перхлораты щелочноземельных металлов обладают высокой гигроскопичностью, поэтому они обычно не применяются ни в ракетной технике, ни для пиротехнических целей. Перхлорат магния широко используется как очень эффективный осушитель. [36]
Однако при большом избытке ионов М и С1 - вклад диффузионного потенциала в суммарный потенциал цепи пренебрежимо мал. Обычно для этой цели используют перхлораты щелочных металлов или тетраалкиламмония, так как они хорошо растворяются во многих апротонных растворителях, а восстановление катиона или окисление аниона не мешает протеканию большинства электродных процессов. [37]
ПИРОТЕХНИЧЕСКИЕ ИСТОЧНИКИ ГАЗОВ ( твердые источники газов), твердые хим. композиции, выделяющие газ заданного состава в результате горения. После инициирования фронт горения продвигается по блоку со скоростью от долей мм / с до десятков мм / с, а т-ра в зоне горения достигает 400 - 1000 С и выше. Твердые источники О2 состоят из хлората или перхлората щелочного металла, пероксида и порошка металла. Известны составы, не содержащие металл; напр. Твердые источники N3 состоят из азида металла ( обычно № К3) и окислителя-оксида, пероксида, перхлората, нитрата, сульфата, галогенида металла и т.п.; напр. Твердые источники Н2 содержат гидриды - М § Н2, 1Л [ ВН4 ], Ка [ А1Н4 ] и др., соли МН или Нб или оксиды металлов; напр. [38]
Ни один из безводных перхлоратов щелочноземельных металлов не имеет четко выраженной температуры плавления. При термическом анализе перхлоратов магния и кальция4 кривые температур характеризуются температурными остановками, которые могут быть приняты за температуры плавления или разложения гидратов. Калориметрическими определениями7 установлено, что перхлорат кальция аналогично перхлоратам щелочных металлов разлагается с образованием хлористого кальция. При разложении гексагидрата перхлората магния наблюдается заметная потеря в весе без резкого излома кривой температура-вес; продуктом распада является окись магния. [39]
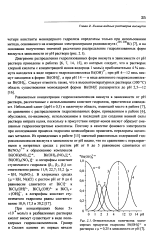 |
Относительные количества мономерных продуктов гидролиза Bi ( OH в растворах с ц 0 25 в зависимости от рН. [40] |
Равновесные концентрации гидроксокомплексов висмута в зависимости от рН раствора, рассчитанные с использованием констант гидролиза, практически совпадают. Небольшой сдвиг ( АрН s 0 3) в щелочную область, имеющий место в работе [7], по сравнению с распределением гидролизованных форм, приведенным в работе [6], обусловлен, по-видимому, использованием в последней для создания ионной силы раствора нитрата калия, поскольку в присутствии нитрат-ионов висмут образует смешанные гидроксонитратные комплексы. Поэтому в качестве фонового электролита при исследовании процесса гидролиза целесообразно применять перхлораты щелочных металлов. [41]
На форму ассоциации в большой мере влияет гидратация ( в общем случае - сольватация) ионов. При слабой сольватации молекулы растворителя вытесняются из пространства между ассоциирующимися ионами и образуются контактные ионные пары. При сильной сольватации ионы в ассоциате разделены молекулами растворителя. Кондуктометрическсе изучение ассоциации в водных растворах хлоратов и перхлоратов щелочных металлов показало [866], что в сравнимых условиях ассоциаты образуются тем интенсивнее, чем больше кристаллографический радиус иона и слабее гидратация. Поведение ионов хлоратов и перхлоратов в процессе ассоциации различно. [42]
Обычно используют 70 - 72 % - ный водный раствор этой кислоты. Чистое вещество, которое можно получить вакуумной перегонкой в присутствии дегидратирующего агента Mg ( ClO4) 2, устойчиво при 25& С лишь несколько суток и разлагается с образованием СЬО. Чистая кислота и ее концентрированные растворы со взрывом реагируют с органическими веществами. Анион СЮ - очень слабый лиганд, поэтому хлорная кислота и перхлораты щелочных металлов часто применяют для приготовления растворов, в которых комплексообразование катионов сведено к минимуму. [43]
Хлорная кислота может служить удобным сырьем для получения различных неорганических и органических перхлоратов. Для большого числа перхлоратов, выпускаемых в ограниченном масштабе и используемых в качестве реактивов, производство их через хлорную кислоту наиболее удобно и экономично. В определенных условиях реакция нейтрализации хлорной кислоты соответствующими основаниями может оказаться целесообразной не только для получения перхлората магния, алюминия, бериллия и других металлов, но также и для получения перхлоратов щелочных металлов и аммония. [44]
Метод был впервые разработан для анализа алюминия. После растворения образца к раствору добавляют небольшие количества нерадиоактивных элементов, служащих носителями для групп элементов, подлежащих разделению. После обработки сероводородом сначала осаждают те элементы, сульфиды которых нерастворимы в кислой среде. После этого последовательно осаждаются элементы, гидроокиси которых нерастворимы в аммиачной среде; элементы, чьи сульфиды выпадают в осадок в щелочной среде; элементы, имеющие нерастворимые карбонаты, и, наконец, перхлораты щелочных металлов. [45]
Страницы: 1 2 3