Перхлорат-ион
Cтраница 1
Перхлорат-ион ведет себя так, как это можно ожидать; у него если и не отсутствует полностью, то выражена в очень слабой степени склонность к комплексообразованию. Различие в поведении ионов нитрата и перхлората вытекает из различий в их структуре. Ион перхлората имеет тетраэдрическое строение, связи атома хлора с атомами кислорода равноценны, поэтому ион слабо поляризуется. У нитрат-иона, являющегося компланарным ионом, связь N - О частично носит ионный характер, вследствие чего он сильно поляризован и имеет эффективный ионный радиус меньший, чем геометрический. Большой поляризуемостью нитрат-иона объясняется его аномальное поведение. [1]
Перхлорат-ион обладает очень небольшой склонностью к образованию комплексов с катионами. [2]
Перхлорат-ион лучше, чем хлор-ион, конкурирует за ионообменные центры, и элюирование ионов металлов происходит быстрее. На рис. 8.4 показан пример разделения, для осуществления которого к элюенту, содержавшему 1 М НС1, добавили 4 5 М хлорной кислоты. [3]
Перхлорат-ион, как правило, считают наиболее слабым комплексообразующим агентом из обычных анионов. [4]
Перхлорат-ион с большим трудом восстанавливается в водном растворе до хлорида. [5]
Перхлорат-ион образует окрашенные комплексы с некоторыми органическими веществами, на чем основано его спектрофото-метрическое определение. Соединение СЮ4 - с катионом метиле-нового синего имеет максимум светопоглощения при 645 ммк. Можно также осадить С1О4 - избытком метиленового синего и фотометрически определить количество непрореагировавшего красителя. [6]
Перхлорат-ион образует нерастворимый осадок с ионом тет - L афениларсония. Образующийся кремовый осадок промывают эфиром и сушат при 110 С. В отличие от нитронного метода [68] в данном методе отпадает необходимость выдерживания раствора с осадком при 0 С. [7]
Поскольку перхлорат-ион, как правило, не образует в водных растворах комплексов с ионами металлов, интенсивность его линии не будет изменяться даже при высоких концентрациях многозарядных катионов. Перхлорат-ион применялся в качестве стандарта во многих исследованиях водных растворов. [8]
Поэтому перхлорат-ион должен каким-то иным образом участвовать в электродной реакции, - возможно, путем обмена кислородом с окис-ной пленкой. Емкость электрода, вычисленная из кривых спада потенциала ( по методу прерывания тока) на нижнем отрезке тафелевской зависимости, необычно велика ( до 90 мкф / см2), но значительно снижается ( до 20 мкф / см2) при высоких плотностях тока. Наконец, в условиях, соответствующих верхнему отрезку тафелевской кривой, происходит выделение озона. [10]
Определению перхлорат-ионов мешают ионы СЮ -, которые обесцвечивают красители. При определении перхлорат-ионов с малахитовым зеленым хлорат-ионы мешают в 5-кратном, хлорид-ионы - в 75-кратном количестве. [11]
 |
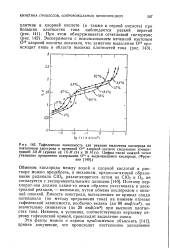
Распределение гафния в зависимости от кислотности раствора или общей концентрации электролита в водной фазе. [12] |
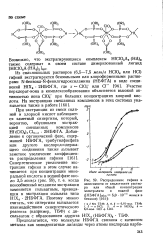
Участие перхлорат-иона в комплексообразовании объясняется высокой активностью иона C1OJ при больших концентрациях хлорной кислоты. [13]
 |
Конфигурация молекулы стрихнина. [14] |
Симметрия перхлорат-иона: собственная 43т; в кристалле тт. [15]
Страницы: 1 2 3 4