Плотность - электронный заряд
Cтраница 1
 |
Строение итс-связи АА. [1] |
Плотность электронного заряда в облаке распределяется симметрично между концами и оказывается наибольшей вблизи каждого из атомов и в узкой перемычке между этими двумя областями. [2]
Плотность электронных зарядов в связывающих орбитах в зависимости от степени ковалентности связи может быть почти полностью локализована у атомов лигандов или распределена между лигандами и центральным атомом металла практически поровну. Орбиты 2alg, 2eg и 3tiu являются практически несвязывающими и локализованы в основном у лигандов. По причинам симметрии орбиты ltig и Н2и принадлежат исключительно ли-гандам. Они являются частично разрыхляющими для связи между отдельными лигандами и совершенно несвязывающими в направлении лиганд-центральный атом металла. Орбиты от 2 2 до 4 / [ и являются несвязывающими и относятся к электронам, которые принадлежат атому металла или могут быть поделены между атомом металла и лигандами. Но строгих правил здесь не существует, и распределение электронов в разных комплексах может быть совершенно различным. В некоторых комплексах даже я - и я - орбиты могут иметь преимущественно ковалентный характер. [3]
Распределение плотности электронного заряда в таких молекулах довольно сложно. В них обнаруживаются точки и с повышенной и с пониженной электронной плотностью. Некоторые орбиты могут быть и свободными, и тогда на них при соответствующих условиях могут перейти электроны от другой частицы. Частица, отдающая электрон, называется донором, а частица, принимающая электрон - акцептором. [4]
Таким образом, выражение плотности электронного заряда суммой квадратов атомных орбиталей приводит к весьма существенному упрощению вида матричных элементов в самосогласованной задаче ( разумеется, подобные упрощения могут быть сделаны и при вычислении матричных элементов в методе наложения конфигураций), что дает возможность проводить соответствующие расчеты для сложных молекул в реальном масштабе времени. [5]
Значит, в обычных обстоятельствах плотность электронного заряда & сверхпроводниках почти идеально однородна, и я вправе считать р постоянным. А это означает, что в J не входит член с р-импульеом. Согласно выражению (19.18), ток пропорционален р, умноженному на А. [6]
У гетерополярных молекул картина распределения плотности электронного заряда имеет гораздо более классический характер. Около одного из ядер группируется избыток электронов, около другого, наоборот, имеет место недостаток электронов. [7]
Для того чтобы найти выражение, которое описывает взаимодействие между плотностью электронного заряда - ер и зарядом ядра, имеющего радиус К, вводятся следующие предположения: а) распределение обоих зарядов ( ядра и электронов) считается сферически симметричным и б) в пределах размеров ядра плотность заряда электронов остается неизменной. [8]
Агеева прежде всего была достаточно ясно продемонстрирована реальность понятия о распределении плотности электронного заряда в валентных связях в молекуле. И это показывает, что распределение плотности электронного заряда может быть не только выведено из теоретических расчетов квантовой механики, но и продемонстрировано, получено на опыте. [9]
АН СССР Н. В. Агеев в своем выступлении представил нам экспериментальные данные о распределении плотности электронного заряда в валентных связях органических молекул, полученные методом рассеяния рентгеновских лучей в органических кристаллах. Мы упомянули об этом методе в докладе и считаем его весьма перспективным. [10]
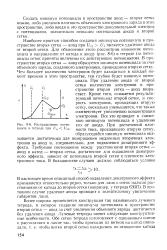 |
Распределение потенциала в тетроде при Ua ( УС2. [11] |
Создать минимум потенциала в пространстве анод - вторая сетка можно, либо увеличив плотность объемного электронного заряда в этом пространстве, либо введя в это пространство дополнительный электрод с потенциалом, значительно меньшим потенциалов анода и второй сетки. [12]
 |
Значения электроотрицательности. [13] |
Понятие электроотрицательности важно также в теоретической органической химии, где можно установить корреляцию между химической реакционной способностью и плотностью электронного заряда на отдельных атомах. Энергия ионизации s - электрона больше, чем р-электрона, так как s - электрон находится под более сильным воздействием ядра. Это означает, что чем больше s - характер гибридной ( sp) орбитали, тем больше будет эффективная электроотрицательность атома, на котором образуется эта орбиталь. Таким образом, электроотрицательность атома углерода в ацетилене ( sp - гибридизация) больше, чем в метане, где углерод использует гибридные 5р3 - орбитали. Этим объясняются кислотные свойства ацетилена, например легкость, с которой один из его атомов водорода может быть замещен натрием. [14]
Метод Томаса - Ферми основан на так называемой статистической модели атома, в которой предполагается непрерывное распределение электронных зарядов в атоме с плотностью, удовлетворяющей уравнению Пуассона ( стр. Плотность электронных зарядов вычисляется независимо с помощью квантовой статистики ( стр. [15]
Страницы: 1 2 3