Плотность - отрицательный заряд
Cтраница 4
Обобществленные электроны чаще всего находятся в области перекрытия, поскольку там на них действуют силы притяжения обоих ядер, что приводит к уменьшению энергии электронов. Следовательно, в области перекрытия электронных оболочек возрастает плотность отрицательного заряда, способствующего сближению ядер взаимодействующих атомов, в результате чего молекула становится устойчивой. [46]
Делокализованные Лторбитали бензольного кольца особенно эффективно передают влияние заместителя от одной части молекулы к другой. Так, например, нитрогруппа в молекуле нитробензола снижает плотность отрицательного заряда ароматического кольца по сравнению с самим бензолом. Нитрогруппа представляет собой электроноакцепторную группу в противоположность отрицательно заряженному атому кислорода фенолят-иона XXI, который выполняет функцию элекроно-донорной группы. Из-за наличия электроноакцепторной группы нитробензол гораздо труднее, чем бензол, подвергается атаке положительными ионами или молекулами, характеризующимися недостатком электронов ( например, окислителями, такими, как КМпО4), которые являются типичными реагентами, участвующими в нормальных реакциях замещения ароматических соединений ( см. стр. [47]
Делокализованные ллорбитали бензольного кольца особенно эффективно передают влияние заместителя от одной части молекулы к другой. Так, например, нитрогруппа в молекуле нитробензола снижает плотность отрицательного заряда ароматического кольца по сравнению с самим бензолом. Нитрогруппа представляет собой электроноакцепторную группу в противоположность отрицательно заряженному атому кислорода фенолят-иона XXI, который выполняет функцию элекроно-донорной группы. Из-за наличия электроноакцепторной группы нитробензол гораздо труднее, чем бензол, подвергается атаке положительными ионами или молекулами, характеризующимися недостатком электронов ( например, окислителями, такими, как КМпО4), которые являются типичными реагентами, участвующими в нормальных реакциях замещения ароматических соединений ( см. стр. [48]
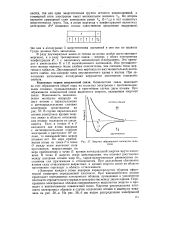 |
Энергия образования молекулы водорода. [49] |
Электрон каждого атома водорода характеризуется облаком сферической симметрии определенной плотности. При взаимодействии атомов происходит перекрывание электронных облаков, приводящее к увеличению плотности отрицательного заряда в пространстве между двумя ядрами. Перекрывание электронных облаков сопровождается выделением энергии и приводит к возникновению ковалентной связи. Картина распределения плотности электронных облаков в случае соединения атомов в молекулу показана на рис. 58, а. [50]
Максимальная электронная плотность отвечает наибольшей вероятности нахождения электрона. Следовательно, понятие орбиталь подразумевает форму электронного облака, которая меняется в зависимости от плотности отрицательного заряда. Орбитали могут отличаться одна от другой энергией, необходимой для удаления отрицательного заряда, формой электронного облака и ориентацией электронного облака относительно центра симметрии - ядра атома. В этом проявляется дискретность характеристик электрона, квантованность его свойств. [51]
Вероятно, это вызвано усилением прочности связи железа в сплаве, в связи с чем падает число ионов Fe2, переходящих в шлак при образовании двойного слоя. В обратном направлении влияет рост содержания 5Ю2 и А12О3; количество ионов Fe2 повышается и плотность отрицательного заряда на металле увеличивается. [52]
Моногенность связи Н-X ( с положительным водородом) зависит, по-видимому, прежде всего от поверхностной плотности отрицательного заряда на X. Наоборот, осуществить обратный процесс - извлечь протон из HsO - для X тем легче, чем больше плотность отрицательного заряда на его поверхности. [53]
Ионогенность связи Н-X ( с положительным водородом): зависит, по-видимому, прежде всего от поверхностной плотности отрицательного заряда на X. Наоборот, осуществить рбратный процесс - извлечь протон из Н3О - для X тем легче, чем больше плотность отрицательного заряда на его поверхности. [54]
Ионогенность связи Н-X ( с положительным водородом) зависит, по-видимому, прежде всего от поверхностной плотности отрицательного заряда на X. Наоборот, осуществить обратный процесс - извлечь протон из Н3О - для X тем легче, чем больше плотность отрицательного заряда на его поверхности. [55]
Весьма вероятно, что и на а-углеродном атоме плотность заряда также соответственно изменяется. Таким образом, если рассматривать катион лития как льюисовскую кислоту, сила которой зависит от степени сольватации, то результат взаимодействия аниона с льюисовской кислотой состоит в переносе некоторой плотности отрицательного заряда от аниона на акцептор. [56]
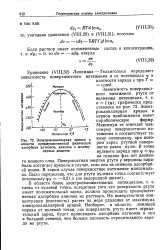 |
Электрокапиллярная кривая в области преимущественной физической адсорбции катионов, анионов и молекулярных веществ. [57] |
Их поверхностная концентрация ( плотность) растет по мере удаления от максимума электрокапиллярной кривой. Наоборот, в области, лежащей справа от нулевой точки, где поверхность ртути имеет отрицательный заряд, будет происходить адсорбция катионов и тем в большей степени, чем больше плотность отрицательного заряда на ртути. [58]
Страницы: 1 2 3 4