Электронная плотность
Cтраница 3
Электронная плотность в молекуле бутадиена распределена сверху и снизу от плоскости а-связей. [31]
Электронная плотность в молекуле бензола распределена по обе стороны от плоскости 7-связей. [32]
Электронные плотности в точках 1 и 2 должны быть одинаковы ( так же как и электронные плотности в точках 3 и 4), поскольку они также меняют ся местами при этой операции двукратного 2л / лповорота. [33]
Электронная плотность особенно сильно уменьшается в орто - и пара-положениях к нитрогруппе. [34]
 |
Возможные конформации молекул триалкилбора. [35] |
Электронная плотность на атоме бора определяется степенью дело-кализации связи В-С. [36]
Электронная плотность не уменьшается резко, начиная с расстояния 75 А от центра, но постепенно понижается от 60 А приблизительно до 85 А. А, в то время как максимальное расстояние от центра до края частицы составляет около 85 А. [37]
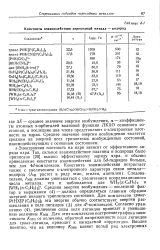 |
Константы взаимодействия переходный металл - водород. [38] |
Электронная плотность на ядре зависит от эффективного заряда ядра. Так, сильное взаимодействие платины и водорода было приписано [20] высоко эффективному заряду ядра, и обычно приведенные константы взаимодействия для Sd-гидридов больше, чем для 4й - комплексов. Средняя энергия возбуждения - последний фактор в выражении ( 4) - должна определяться главным образом энергией низшего триплетного состояния. Для комплексов транс - PtHXlPtCaHsbb эта энергия обычно соответствует энергии расщепления в поле лигандов ( Д) для - комплексов. Согласно уравнению ( 4), увеличение силы поля лигандов приведет к уменьшению величины / Смн. Для этих комплексов построение графика зависимости / Смн от величины, обратной напряженности поля лигандов для г / зонс-лиганда, приводит к ожидаемой корреляции. [39]
Электронная плотность qr, которую можно рассматривать как число л-электронов, принадлежащих данному атому, не всегда является целым числом. [40]
Электронная плотность каждого углеродного атома в нейтральных молекулах АУ равна единице. [41]
Электронная плотность на каждом атоме углерода в нейтральных АУ равна единице. [42]
Электронная плотность ls - орбитали находится ближе к ядру, чем плотность 2я - орбитали. [43]
Электронная плотность характеризует вероятность пребывания нелокализованного я-электрона у рассматриваемого атома. Чем выше эта величина, тем более отрицательно заряжен данный атом. Эта характеристика определяет направление превращения молекулы при воздействии на нее заряженных частиц. [44]
Электронная плотность q, создаваемая электроном на рассматриваемом атоме г, определяется квадратом коэффициента сг, с которым орбиталь атома г входит в выражение молекулярной волновой функции. Общая электронная плотность берется как сумма электронных плотностей, создаваемых каждым электроном. [45]
Страницы: 1 2 3 4