Поведение - идеальный раствор
Cтраница 1
Поведение идеальных растворов описывается особенно простыми законами, но является совершенно гипотетическим, и пр ак-тические реальные растворы, в действительности встречающиеся в промышленных условиях, могут только более или менее приближаться к нему. [1]
Поведение идеальных растворов описывается простыми законами, но является совершенно гипотетическим, и реальные растворы, в действительности встречающиеся в промышленных условиях, могут только более или менее приближаться к этому идеальному предельному эталону. [2]
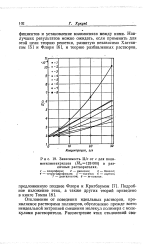 |
Зависимость П / с от с для поли-метилметакрилата (. № 128000 в различных растворителях. [3] |
Отклонение от поведения идеальных растворов, проявляемое растворами полимеров, обусловлено прежде всего неидеальной энтропией смешения молекул полимера с молекулами растворителя. [4]
Согласно уравнению (2.31) отклонения поведения идеального раствора от закона Рауля становятся заметными, если разность между давлениями паров чистых - компонентов велика. При этом ( компонент, обладающий меньшим давлением пара, дает положительные отклонения от закона Рауля, а компонент, давление пара которого больше, - отрицательные отклонения. Можно показать также, что общее давление пара раствора в этом случае будет меньше, чем давление пара раствора, которым обладал бы раствор, если бы закон Рауля соблюдался строго. [5]
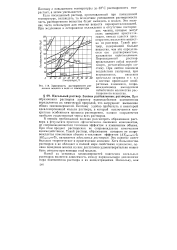 |
Зависимость растворимости различных веществ в воде от температуры. [6] |
Одной из основных закономерностей поведения идеальных растворов является зависимость между парциальными давлениями пара компонентов раствора и их концентрациями. [7]
В действительности, смесь изотопов неона несколько отклоняется от поведения идеального раствора, а ее паровая фаза, кроме того, не строго подчиняется законам идеальных газов. [8]
Для того чтобы с пользой применять законы, управляющие поведением идеальных растворов, мы можем использовать принцип предельного закона. Если содержание растворенных молекул в растворе относительно мало, то взаимодействия между ними будут минимальными и, следовательно, они будут слабо влиять на поведение растворителя. [9]
Таким образом, в соответствии с определением любое отклонение от поведения идеального раствора для регулярного раствора полностью обусловлено теплотой смешения. [10]
Таким образом, в соответствии с определением любое отклонение от поведения идеального раствора в регулярном растворе полностью обусловлено теплотой смешения. [11]
Этот закон и другие связанные с ним зависимости, характеризующие поведение идеальных растворов, можно вывести расчетным путем, исходя из простых моделей, методами статистической механики. [12]
Значения величины а, не равные единице, характеризуют отклонение от поведения идеального раствора. [13]
Чем выше концентрация вещества в растворе, тем в большей степени отличается поведение реального раствора от поведения идеального раствора. [14]
При расчетах полагалось, что поведение расплавленных солей хлоридов гафния, натрия и калия близко к поведению идеальных растворов. [15]
Страницы: 1 2 3