Поведение - идеальный раствор
Cтраница 2
Описанный метод позволяет определять также степень взаимодействия по - k лимера с растворителем, характеризуемую отклонением системы от поведения идеального раствора. [16]
При этом поведение газовой фазы может значительно отклоняться от поведения идеального газа, но должно находиться в хорошем соответствии с поведением идеального раствора. [17]
Мп - его средне-числовой молекулярный вес; v - молярный объем растворителя; В - второй вириальный коэффициент, являющийся мерой отклонения от поведения идеального раствора; р и рй - давление паров раствора и растворителя соответственно. [18]
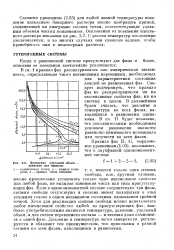 |
Диаграмма удельный объем - давление для пропана. [19] |
Согласно уравнению (2.03) для любой данной температуры поведение идеального бинарного раствора можно изобразить прямой, соединяющей на диаграмме состава точки, соответствующие удельным объемам чистых компонентов. Отклонения от поведения идеального раствора показаны на рис. 2.7. С ростом температур отклонения увеличиваются, и во многих случаях они слишком велики, чтобы пренебрегать ими в инженерных расчетах. [20]
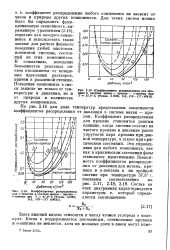 |
Коэффициенты распределения для пропана в системе метан - пропан - - н-пентан при Т 37 8 С [ Trans. AIME, 142, 170 - 177 ( 1941 ]. [21] |
Для таких систем можно было бы определить функциональную зависимость, выраженную уравнением (2.16), отдельно для каждого компонента и использовать такие данные для расчета фазового поведения любой многокомпонентной системы, состоящей из этих компонентов. К сожалению, поведение большинства реальных систем отклоняется от поведения идеальных растворов, причем в различной степени. Поведение компонента в смеси зависит не только от температуры и давления, но и от природы и количества других компонентов. [22]
Метод измерения давления пара, подобно эбуллиоскопии, не пригоден для количественного изучения ионных равновесий, кроме самых простых случаев, так как для контроля коэффициентов активности нельзя использовать фазовый электролит. Однако метод полезен для исследования равновесий в раство - pax, содержащих незаряженные формы, поведение которых близко к поведению идеальных растворов. Хотя метод с измерением давления пара менее точен, чем криоскопия или эбуллиоскопия, он имеет то большое преимущество, что может проводиться в широкой области температур, при которых растворитель является жидкостью. Более того, результаты, полученные изопиестическим методом, изотермичны. [23]
Вследствие неизвестности абсолютных значений термодинамических величин ( кроме энтропии) химический потенциал отсчитывают от произвольно выбранного значения в так называемом стандартном состоянии. Стандартное состояние удобно выбирать так, чтобы для него выполнялось условие Астандм и в стандартном состоянии поведение реального раствора совпадало бы с поведением идеального раствора. [24]
Измерение плотности расплавов системы Fe - Cull, 90 ] показывает, что при смешении жидких железа и меди наблюдается декомпрессия. Авторы [106] на основании полученных сведений о концентрационной зависимости р расплавов Fe-Си делают вывод, что свойства расплавов этой системы имеют положительные отклонения от поведения идеальных растворов. [25]
Хотя реальные системы строго не подчиняются уравнению (10.38), поведение ряда бинарных и многокомпонентных систем при4 давлениях, представляющих промышленный интерес, приближается к поведению идеального раствора. [26]
Хотя реальные системы строго не подчиняются уравнению (10.38), поведение ряда бинарных и многокомпонентных систем при давлениях, представляющих промышленный интерес, приближается к поведению идеального раствора. [27]
Экспериментальные наблюдения показывают, что объем даже неидеальных газов складывается почти аддитивно и образующаяся смесь газов по своему поведению близка к идеальному газу. Однако объем большинства жидкостей не является аддитивным свойством и образующиеся растворы по своему поведению сильно отклоняются от идеальных. Степень отклонения от поведения идеальных растворов можно рассматривать в связи с межмолекулярными силами, которые относительно малы в смеси газов, но могут быть достаточно большими в жидких растворах. Рассмотрим парциальные мольные величины в применении к этим растворам. [28]
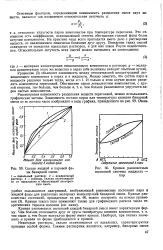 |
Состав жидкой и паровой фазы бинарной смеси. / - идеальный раствор. 2 - неидеальный раствор. 3 - раствор, сильно отличающийся от идеального и образующий азеотроп-ную смесь.| Кривая равновесных. [29] |
На практике чаще всего приходится иметь дело с растворами веществ, не являющимися химически близкими друг другу. Поведение таких смесей отличается от поведения идеальных растворов, и для них закон Рауля недействителен. [30]
Страницы: 1 2 3